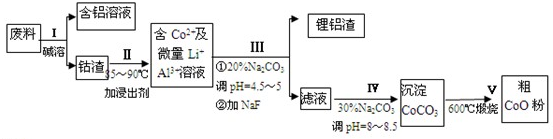
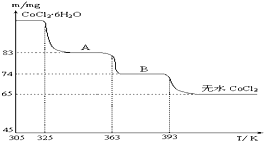
题目内容
5.过量的锌粉和100ml 6mol•L-1的盐酸反应,当向其中加入少量的下列物质时,能够减慢反应速率,又不影响产生H2总量的是( )①醋酸钠固体 ②Na2CO3晶体 ③氯化钠溶液 ④铁粉 ⑤浓盐酸 ⑥NaOH晶体.
| A. | ①③④ | B. | ①③ | C. | ②④⑥ | D. | ②⑤⑥ |
分析 能够减慢反应速率,可使氢离子浓度降低,又不影响产生H2总量,则氢离子的总物质的量不变,以此解答该题.
解答 解:①加入醋酸钠固体,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故正确;
②加入Na2CO3晶体,消耗盐酸,生成氢气的总量减少,故错误;
③加入氯化钠溶液,溶液体积增大,氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故正确;
④加入铁粉,形成原电池反应,反应速率增大,故错误;
⑤加入浓盐酸,反应速率增大,生成氢气的总量增多,故错误;
⑥加入NaOH晶体,氢离子浓度降低,反应速率减小,但生成氢气的总量也减少,故错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高考高频考点,注意题目的要求,答题时注意审题,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
15.下列物质既具有氧化性又有还原性的是( )
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
20.下列关于金属氧化物的说法中正确的是( )
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
14.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
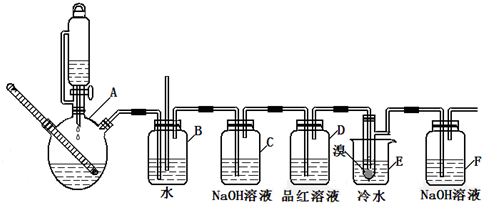
有关数据如表:
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.

有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.