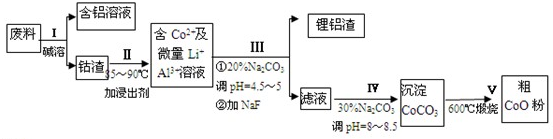
题目内容
6. 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:
H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②c(NO2- )/c(H+) ③Ka(HNO2)
④c(H+ )/c(HNO2) ⑤c(OH -) ⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$
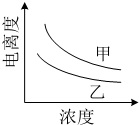
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反应醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO3-、CH3COO-、CN- b.HCO3-、CH3COOH、CN-、CO32-
c.HCN、HCO3-、CN-、CO32-d.HCN、HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
分析 (1)电离常数越大,酸的酸性越强;根据HCO3-?CO32-+H+结合电离常数的含义书写;
(2)根据酸与碱反应时氢离子与氢氧根离子之间的关系判断;
(3)0.01mol•L-1的HNO2溶液加水稀释,促进HNO2的电离,电离常数不变;
(4)酸的电离常数越大,相同浓度时电离程度越大;
(5)根据表中电离平衡常数可知,酸性大小为:HNO2>CH3COOH>H2CO3>HCN>HCO3-,
a.碳酸的酸性大于HCN,H2CO3与CN-能反应生成HCN;
b.CH3COOH的酸性大于碳酸,CH3COOH与CO32-、HCO3-能反应;
c.HCN的酸性大于HCO3-,HCN与碳酸根离子反应生成碳酸氢根离子;
d.四种粒子之间不发生反应,可以共存;
(6)HNO2与碳酸盐反应生成二氧化碳气体,即可证明HNO2酸性强于碳酸.
解答 解:(1)电离常数越大,酸的酸性越强,表中电离常数最大的是HNO2;已知HCO3-?CO32-+H+,则HCO3-的电离平衡常数表达式K=$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$;
故答案为:HNO2;$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$;
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3为一元酸,其电离方程式为:H3BO3+H2O?B(OH)4-+H+;
故答案为:一;H3BO3+H2O?B(OH)4-+H+;
(3)①加水稀释,促进HNO2的电离,由于溶液体积增大的程度大于氢离子物质的量的增大程度,所以c(H+)减小,故错误;
②加水稀释,促进HNO2的电离,NO2- 的物质的量增大,H+的物质的量增大,但是水也电离出氢离子,所以 c(NO2- )/c(H+) 减小,故错误;
③Ka(HNO2)只与温度有关,温度不变,Ka(HNO2)不变,故错误;
④加水稀释,促进HNO2的电离,H+的物质的量增大,HNO2的物质的量减少,所以c(H+ )/c(HNO2)增大,故正确;
⑤加水稀释,促进HNO2的电离,由于溶液体积增大的程度大于氢离子物质的量的增大程度,所以c(H+)减小,则c(OH -)增大,故正确;
⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$=$\frac{Ka}{Kw}$,由于Ka、Kw只与温度有关,所以$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$不变,故错误;
故答案为:④⑤;
(4)酸的电离常数越大,相同浓度时电离程度越大,所以HNO2的电离常数大,则相同浓度时HNO2的电离度大,即甲为HNO2,乙为醋酸;
故答案为:乙;
(5)根据表中电离平衡常数可知,酸性大小为:HNO2>CH3COOH>H2CO3>HCN>HCO3-,
a.碳酸的酸性大于HCN,H2CO3与CN-能反应生成HCN,所以H2CO3与CN-不能共存,故a错误;
b.CH3COOH的酸性大于碳酸,CH3COOH与CO32-、HCO3-能反应,所以CH3COOH与CO32-、HCO3-不能大量共存,故b错误;
c.HCN的酸性大于HCO3-,HCN与碳酸根离子反应生成碳酸氢根离子,所以不能大量共存,故c错误;
d.四种粒子之间不发生反应,可以共存,故d正确;
故答案为:d;
(6)酸性强的酸与酸性弱的酸的盐反应可以生成酸性弱的酸,用HNO2溶液与碳酸氢钠(或其它碳酸盐)反应,有无色气体产生,从而证明HNO2酸性强于碳酸;
答:用HNO2溶液与碳酸氢钠(或其它碳酸盐)反应,有无色气体产生,从而证明HNO2酸性强于碳酸.
点评 本题考查了弱电解质的电离、电离常数的应用、粒子共存的判断等,题目难度中等,根据表中数据正确判断酸性强弱为解答关键,注意明确酸性强弱与电离平衡常数的关系,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案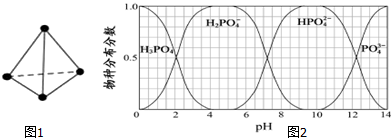
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是加快Fe和稀硫酸的反应速率.
(2)为了使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是CD.
A.加热,使反应在较高温度下进行 B.用氨水调节pH=7
C.加入适当过量的H2O2溶液 D.缓慢滴加H2O2溶液并搅拌
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为Fe(OH)3(写化学式).
(4)化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可简单的理解为断开1 mol 化学键时所吸收的能量.下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图2所示.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5(介于此区间内的任意值或区间均可);pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-).
| A. | 分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 | |
| B. | 先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 | |
| C. | 两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 | |
| D. | 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
| A. | 加NH4Cl溶液 | B. | 加浓氨水 | C. | 加水稀释 | D. | 加NaOH溶液 |
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
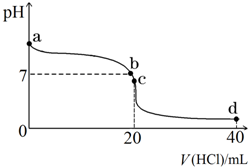 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示. .
.