题目内容
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1.下列判断错误的是( )
| A、x=1 |
| B、2min内A的反应速率为0.3mol?L-1?min-1 |
| C、B的转化率为50% |
| D、若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A、根据n=cV计算生成C的物质的量,结合D的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B、根据v=
计算v(D),再利用速率之比等于化学计量数之比计算v(A);
C、根据生成的D的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的B的物质的量,再利用转化率定义计算;
D、反应前后质量不变,气体体积变化,则混合气体的平均相对分子质量始终在变.
B、根据v=
| ||
| △t |
C、根据生成的D的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的B的物质的量,再利用转化率定义计算;
D、反应前后质量不变,气体体积变化,则混合气体的平均相对分子质量始终在变.
解答:
解:平衡时生成的C的物质的量为0.2mol?L-1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,依据化学平衡三段式列式计算平衡浓度; 3A(g)+B(g)?C(g)+2D(g).
起始量(mol/L) 1.5 0.5 0 0
变化量(mol/L) 0.6 0.2 0.2 0.4
平衡量(mol/L) 0.9 0.3 0.2 0.4
A、根据以上分析x=1,故A正确;
B、2min内生成0.8mol D,故2 min内D的反应速率v(D)=
=0.2 mol?(L?min)-1,速率之比等于化学计量数之比,故v(A)=
v(D)=
×0.2 mol?(L?min)-1=0.3 mol?(L?min)-1,故B正确;
C、2min末该反应达到平衡,生成0.8mol D,由方程式3A(g)+B(g)?xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol×
=0.4mol,故B的转化率为
×100%=40%,故C错误;
D、反应前后质量不变,气体体积变化,则混合气体的平均相对分子质量始终在变,若混合气体的平均相对分子质量不变,能说明反应达到平衡状态,故D正确;
故选C.
起始量(mol/L) 1.5 0.5 0 0
变化量(mol/L) 0.6 0.2 0.2 0.4
平衡量(mol/L) 0.9 0.3 0.2 0.4
A、根据以上分析x=1,故A正确;
B、2min内生成0.8mol D,故2 min内D的反应速率v(D)=
| ||
| 2min |
| 3 |
| 2 |
| 3 |
| 2 |
C、2min末该反应达到平衡,生成0.8mol D,由方程式3A(g)+B(g)?xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol×
| 1 |
| 2 |
| 0.4mol |
| 1mol |
D、反应前后质量不变,气体体积变化,则混合气体的平均相对分子质量始终在变,若混合气体的平均相对分子质量不变,能说明反应达到平衡状态,故D正确;
故选C.
点评:本题考查化学平衡的有关计算、反应速率的有关计算、平衡状态的判断等,难度中等,注意平衡状态的判断,三段式列式计算是解题的基本方法.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA |
| B、将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L |
| C、在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
如图:X为铁棒,Y为铜棒,b为电解液.当K闭合后,下列有关分析不正确的是( )


| A、当a为电流表,b为浓硝酸时:Y为负极 |
| B、当a为电流表,b为稀硫酸时:X电极反应为:Fe-2e-=Fe2+ |
| C、当a为直流电源,b为CuSO4溶液时:X、Y两电极附近的 SO42-浓度相等 |
| D、当a为直流电源,b为NaOH溶液,X极附近产生白色沉淀时:电子从X极流出 |
已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An+)〕m?〔C(Bm-)〕n,则BaSO4的Ksp约为( )
| A、2.33×10-4 |
| B、1×10-5 |
| C、1×10-10 |
| D、1×10-12 |

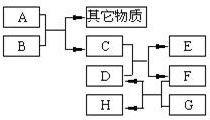 已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.