题目内容
6.下列反应的离子方程式书写不正确的是( )| A. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 小苏打溶液中加入少量石灰水:HCO$\overline{3}$+Ca2++OH-═CaCO3↓+H2O | |
| D. | 用SO2还原含Cr2O72-的酸性废水:Cr2O72-+3SO2+2H+═2Cr3++3SO42-+H2O |
分析 A.氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
B.溶液的pH=7.氢氧化钡与硫酸氢钾的物质的量之比为1:2;
C.石灰水少量,反应生成碳酸钙、碳酸钠和水;
D.重铬酸跟离子在酸性条件下具有强氧化性,能够氧化二氧化硫.
解答 解:A.氯气通入澄清石灰水中,反应生成氯化钙、次氯酸钙和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7,氢离子和氢氧根离子的物质的量相等,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B正确;
C.小苏打溶液中加入少量石灰水,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O,故C错误;
D.SO2还原含Cr2O72-的酸性废水,二者发生氧化还原反应,反应的离子方程式为:Cr2O72-+3SO2+2H+═2Cr3++3SO42-+H2O,故D正确;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
16.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| B. | Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg | |
| C. | 光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
17.化学与社会、生活紧密相关.下列说法不正确的是( )
| A. | 化学危险品发生爆炸事故后,人员应该向上风方向撤离 | |
| B. | 含有硫酸的工业废水用硝酸钡处理后再排放有利于减少水体污染 | |
| C. | 用聚苯乙烯代替聚乙烯作食品包装袋,可节约成本,但是不利于人体健康和环保 | |
| D. | “阅兵蓝”的出现说明京津冀实施道路限行和污染企业停工等措施,可以有效地减轻雾霾和保证空气质量 |
14.硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.1mol/L,硫酸根离子的浓度为0.3mol/L,则混合溶液中镁离子浓度为( )
| A. | 0.15 mol/L | B. | 0.3 mol/L | C. | 0.45 mol/L | D. | 0.2 mol/L |
11.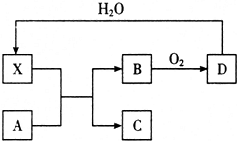 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )| A. | X能使蔗糖变黑主要体现了 X的强氧化性 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | 若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生 | |
| D. | 工业上,B转化为D的反应需使用催化剂 |
18.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)( )
| A. | $\frac{22.4bc}{a}$NAL | B. | $\frac{22.4ab}{c}$NAL | C. | $\frac{22.4ac}{b}$NAL | D. | $\frac{22.4b}{ac}$NA L |
15.下列说法正确的是( )
| A. | 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 乙酸乙酯、硝基苯的制备、银镜反应实验均需要水浴加热 |
16.取1mol/L的硫酸和盐酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为3:2,则往硫酸中加入铁粉的质量为( )
| A. | 2.8g | B. | 4.2g | C. | 8.4g | D. | 11.2g |
