题目内容
16.取1mol/L的硫酸和盐酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为3:2,则往硫酸中加入铁粉的质量为( )| A. | 2.8g | B. | 4.2g | C. | 8.4g | D. | 11.2g |
分析 发生反应为:Fe+H2SO4═FeSO4+H2↑①,Fe+2HCl═FeCl2+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为3:2,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量,通过方程式可以看出来,铁消耗HCl多,故对于②反应来说是盐酸不足,可以算出来生成H2物质的量,根据体积比可算出Fe与硫酸反应生成n(H2),对于①反应是Fe不足,以此计算铁的质量.
解答 解:发生反应为:Fe+H2SO4═FeSO4+H2↑①,Fe+2HCl═FeCl2+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为3:2,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量,通过方程式可以看出来,铁消耗HCl多,故对于②反应来说是盐酸不足,对于①反应是Fe不足,
反应②生成气体的物质的量为$\frac{0.1L×1mol/L}{2}$=0.05mol,反应完毕后生成气体的体积之比为3:2,所以Fe与硫酸生成的气体为0.05mol×$\frac{3}{2}$=0.075mol,
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑
56g 1mol
x 0.075mol
所以,56g:x=1mol:0.075mol,解得x=4.2g,
故选B.
点评 本题考查化学方程式计算,涉及过量计算,通过反应方程式判断反应的过量问题是关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.下列反应的离子方程式书写不正确的是( )
| A. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 小苏打溶液中加入少量石灰水:HCO$\overline{3}$+Ca2++OH-═CaCO3↓+H2O | |
| D. | 用SO2还原含Cr2O72-的酸性废水:Cr2O72-+3SO2+2H+═2Cr3++3SO42-+H2O |
7.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3 的是( )
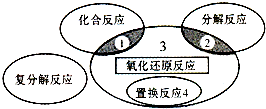

| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | D. | Fe+CuSO4═Cu+FeSO4 |
4.下列有关实验操作说法中,不正确的是( )
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 用量筒、试管、胶头滴管、玻璃棒、蒸馏水和 pH试纸,可鉴别pH 相等的硫酸和醋酸 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
11.下列反应对应的离子方程式书写正确的是( )
| A. | 氢氧化钠溶液与稀硫酸的反应:2OH-+2H+═2H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 向盐酸中投入碳酸钙:CO32-+2H+═H2O+CO2↑ |
1.实验室欲快速制取氢气,应采取的措施是( )
| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
8.在298K、1.01×105 Pa下,将22g CO2通入750mL 1mol•L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量.已知该条件下,1mol CO2通入1L 2mol•L-1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x+2y) kJ•mol-1 |
5.已知某无色溶液中含有Na+,还可能大量存在Ag+、H+、CO32-、Cl-.取出少量原溶液并滴入盐酸会产生气体,但是不会产生白色沉淀.则溶液中( )
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
6.相同条件下,通过相同的电量分别电解CuCl2和AgNO3溶液,若析出64g Cu,则析出Ag的质量是( )
| A. | 108g | B. | 54g | C. | 216g | D. | 64g |