题目内容
1.低碳经济是以低能耗、低污染、低排放为基础的经济模式.低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多哥领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0.
反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol -1
反应②:H2(g)+CO2(g)?H2O (g)+CO(g)△H=+41.2kJ•mol -1
①写出用CO2与H2反应制备甲醇的热化学方程式3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,
②800℃时CO2与H2反应制备甲醇的反应化学平衡常数K的数值为2.5.
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2. 紫外线照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如1图所示.在0~15h内,对反应催化效果最好的催化剂是Ⅱ(填序号).

(3)一定温度下,在3L容积可变的密闭容器中发生上述反应②,已知c(CO)随反应时间t的变化曲线a如图2所示,在t1时刻改变一个条件,曲线a变为b,则改变的条件是加入催化剂.
(4)图3为绿色电源“二甲醚(CH3-O-CH3)燃料电池”的工作原理示意图,b电极为正极(填“正”或“负”);a电极的反应式为CH3OCH3+3H2O-12e-═2CO2+12H+.
分析 (1)已知:①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:3H2(g)+CO2(g)?CH3OH(g)+H2O(g),平衡常数为①、②平衡常数乘积;
(2)相同时间内甲烷产量越大,说明反应速率越快,催化剂效果越好;
(3)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变条件不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
(4)由示意图可知,a电极中二甲醚发生氧化反应生成二氧化碳与氢离子,则a为负极,b为正极.
解答 解:(1)①已知:①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,
故答案为:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol;
②800℃时该反应的化学平衡常数K的数值为2.5×1=2.5,
故答案为:2.5;
(2)由图可知,0-15小时内,相同时间内第Ⅱ种催化剂的作用下收集的CH4最多,反应催化效果最好的催化剂是Ⅱ,
故答案为:Ⅱ;
(3)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
故答案为:加入催化剂;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+,
故答案为:正;CH3OCH3+3H2O-12e-═2CO2+12H+.
点评 本题考查盖斯定律应用、平衡常数有关计算、化学平衡图象与影响因素、原电池等,题目涉及内容较多,基本属于拼合型题目,(4)中注意根据示意图判断产物,难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 五水硫酸铜、SO2、空气 | B. | NH3、Cu、空气 | ||
| C. | 盐酸、硫酸、胶体 | D. | 氨水、食盐、酒精 |
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)Z元素在周期表中的位置是第三周期第ⅦA族;Y的一种氧化物能导致温室效应,该氧化物的电子式火
 ;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是HClO4>HNO3>H2CO3.
(3)实验室制取Z单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)实验室制取X的氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;工业上用此氢化物制取X的最高价含氧酸的第一步反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)实验室用X的氢化物的水溶液制取W的氢氧化物的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
| A. | NO2只起还原剂作用 | B. | NO2起催化剂作用 | ||
| C. | NO2只起氧化剂作用 | D. | O3与O2互为同分异构体 |
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将减小.(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1 000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-═2N2O5+2H+.
| A. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 小苏打溶液中加入少量石灰水:HCO$\overline{3}$+Ca2++OH-═CaCO3↓+H2O | |
| D. | 用SO2还原含Cr2O72-的酸性废水:Cr2O72-+3SO2+2H+═2Cr3++3SO42-+H2O |
| A | B | C | D | |
| 实验 | 用酒精提取溴水中的Br2 | 除去氢氧化铁胶体中的铁离子 | 分离NH4Cl和I2的固体混合物 | 稀释10mL98% 的浓硫酸溶液 |
| 装置或仪器 | 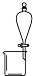 |  |  | 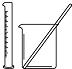 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2 | B. | O2 | C. | CO | D. | CH4 |
| A. | 氢氧化钠溶液与稀硫酸的反应:2OH-+2H+═2H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 向盐酸中投入碳酸钙:CO32-+2H+═H2O+CO2↑ |