题目内容
10.二甲醚(CH3OCH3)被称为21世纪的新型燃料,未来可能替代柴油和液化气作为洁净液体燃料使用.(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
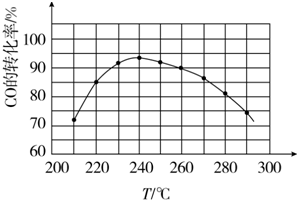
(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.
分析 (1)根据盖斯定律计算△H;平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动;
(3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(4)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;
(5)①将各物质的浓度带入平衡常数表达式,将计算结果与平衡常数进行比较,从而判断平衡移动方向;
②若开始只加入CH3OH,经10min后反应达到平衡,假设开始加入的甲醇为1mol,设转化的甲醇为xmol,表示出平衡时各组分物质的量,反应前后气体物质的量不变,可以用物质的量代替浓度计算平衡常数,根据平衡常数列方程计算解答.
解答 解:(1)已知①2H2(g)+CO(g)???CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=(2a+b+c)kJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$;
故答案为:(2a+b+c)kJ•mol-1;$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动,即向正反应方向移动,CH30CH3的产率增大;
故答案为:增大;
(3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小,
故答案为:温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小;
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;
(5)①该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,将所给浓度带入平衡常数表达式:$\frac{0.5×0.5}{0.4{4}^{2}}$=1.29<400,故反应向正反应方向进行,正反应速率大于逆反应速率;
故答案为:>;
②若开始只加入CH3OH,经10min后反应达到平衡,假设开始加入的甲醇为1mol,设转化的甲醇为xmol,则:
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol):1 0 0
变化量(mol):x 0.5x 0.5x
平衡量(mol):1-x 0.5x 0.5x
反应前后气体物质的量不变,可以用物质的量代替浓度计算平衡常数,则$\frac{0.5x×0.5x}{(1-x)^{2}}$=400mol,解得x=0.975,故甲醇的转化率为$\frac{0.975}{1}$×100%=97.5%;
故答案为:97.5%.
点评 本题考查盖斯定律、化学平衡计算、平衡常数应用、注意理解掌握平衡常数的应用,本题较为综合,题量较大,注意“始、转、平”是解决有关化学平衡的“三段论”解题法,难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案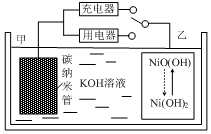 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 大自然利用太阳能最成功的是植物的光合作用 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 化肥的大量使用不会造成环境污染 |
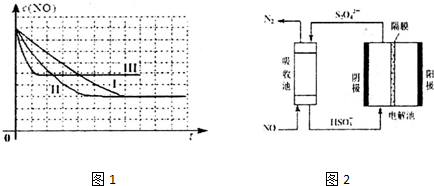
(1)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如图:
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{{c({NO})}}{{c({CO})}}=1$,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$.
(2)使用电化学法也可处理NO的污染,装置如图2.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
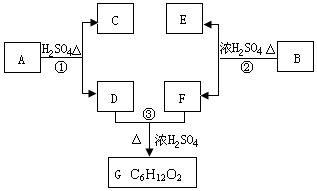 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: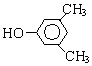 或
或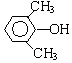 或
或 (写出一种即可).
(写出一种即可). 或
或
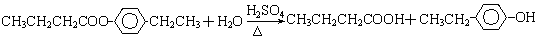 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或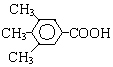 .
. .
.