题目内容
18.用离子方程式解释下列问题:(1)盛放烧碱液的试剂瓶不能用玻璃塞SiO2+2OH-=SiO32-+H2O;
(2)用NaOH溶液除去铝表面的保护层Al2O3+2OH-=2AlO2-+H2O;
(3)制备氢氧化亚铁需隔绝空气4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)实验室制备氯气MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)在氯化铝溶液中加入与过量稀氨水制备氢氧化铝Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 (1)二氧化硅与碱反应生成具有粘合性的硅酸钠;
(2)氧化铝与NaOH溶液反应生成偏铝酸钠和水;
(3)氢氧化亚铁、氧气、水反应生成氢氧化铁;
(4)二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(5)氯化铝和氨水反应生成氢氧化铝和氯化铵.
解答 解:(1)二氧化硅与碱反应生成具有粘合性的硅酸钠,离子反应为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(2)氧化铝与NaOH溶液反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氢氧化亚铁、氧气、水反应生成氢氧化铁,离子反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)二氧化锰与浓盐酸反应生成氯化锰、氯气、水,离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)氯化铝和氨水反应生成氢氧化铝和氯化铵,离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式及电子、电荷守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列关于有机物的叙述正确的是( )
| A. | 糖类、油脂和蛋白质均为高分子化合物 | |
| B. | 利用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| C. | 煤中含有苯、甲苯等,可通过煤的干馏制取 | |
| D. | 苯滴入溴水中振荡后水层接近无色,因为发生了加成反应 |
6.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
3.下列有关离子检验的操作和实验结论正确的是( )
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |
10.实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )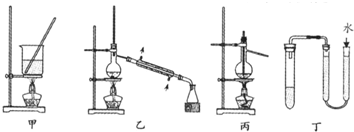

| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
7.常温下,一定浓度的某溶液,由水电离出的 c(OH-)=10-4mol•L-1,则该溶液中的溶质可能是( )
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
8.家用炒菜铁锅用水清洗放置后会出现锈斑,在此变化过程中不发生的化学反应是( )
| A. | Fe-3e一═Fe3+ | B. | Fe2+十20H-═Fe(OH)2 | ||
| C. | 2H20+02+4e-═40H- | D. | 4Fe(OH)2+2H20+02═4Fe(OH)3 |