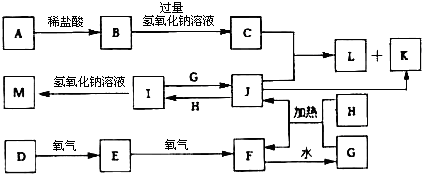
题目内容
13.有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=12.4(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=0.025mol/L和c(NaOH)=0.050mol/L.
分析 发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O、2NaOH+H2SO4=Na2SO4+2H2O,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半,说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的,所以Ba(OH)2、NaOH的物质的量浓度比为1:2,而原溶液中2c[Ba(OH)2]+c(NaOH)=0.1mol/L,当滴到沉淀不再增加时:溶液中只有NaOH提供的OH-,根据c(H+)=$\frac{{K}_{W}}{C(O{H}^{-})}$结合pH=-lgc(H+)求解.
解答 解:用0.025mol/LH2SO4滴定,发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O、2NaOH+H2SO4=Na2SO4+2H2O,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半,说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的,所以Ba(OH)2、NaOH的物质的量浓度比为1:2,
因为pH=13,pH=-lgc(H+),c(H+)=10-13mol/L,可知c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,
所以原溶液中2c[Ba(OH)2]+c(NaOH)=0.1mol/L,故2c[Ba(OH)2]+2c[Ba(OH)2]=0.1mol/L,
设c[Ba(OH)2]=x,则c(OH-)=2x,
2x+2x=0.1,解得x=0.025mol/L,即2c[Ba(OH)2]=0.05mol/L,c(NaOH)=0.050mol/L,
从中取出24mL,V1=24mL,c(H2SO4)=0.025mol/L,c(H+)=0.05mol/L,滴定终点所需硫酸的体积:V2=$\frac{0.1×24}{0.05}$mL=48mL,当滴到沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半为24mL,此时总体积为24mL+24mL=48mL,溶液中只有NaOH提供的OH-,c(OH-)=$\frac{0.05mol/L×24mL}{48mL}$=0.025 mol/L,c(H+)=$\frac{1{0}^{-14}}{0.025}$mol/L=4×10-13 mol/L,pH=-lg4×10-13=12.4,
①由上述计算可知,滴到沉淀不再增加时,溶液的pH为12.4,故答案为:12.4;
②由上述计算可知,原混合溶液中Ba(OH)2物质的量浓度为0.025mol/L,NaOH的物质的量浓度为 0.050mol/L,故答案为:0.025mol/L;0.05mol/L.
点评 本题考查化学方程式的计算,为高频考点,把握信息及方程式确定溶液中氢氧化钡与氢氧化钠物质的量之比为1:2为解答的关键,侧重分析与计算能力的考查,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 聚乙烯和乙烯性质相似,都能发生加成反应 | |
| B. | 纤维素、橡胶和光导纤维都属于有机高分子化合物 | |
| C. | 乙烯和乙醇都可发生加成反应 | |
| D. | 等量的CH4和Cl2在光照下反应不能生成纯净的CH3Cl |
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大H2浓度 | D. | 减小压强 |
①钠和水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
③铁露置在空气中一段时间后就会生锈;性质更活泼的铝露置在空气中也很容易腐蚀
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应;SiO2也不与所有的酸反应
⑤SO2能使酸性高锰酸钾溶液褪色,所以说SO2具有漂白性.
| A. | ①③④⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③④⑤ |
(1)制取Cl2,检验干燥氯气是否有漂白性.
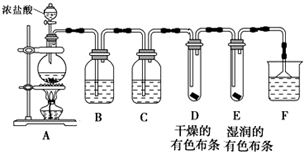
①盛装浓盐酸的仪器的名称是分液漏斗,烧瓶中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②B中盛有饱和食盐水,其作用是除去Cl2中混有的HCl,C中盛装的试剂是浓硫酸
③通入Cl2后,D、E中观察到的现象是中布条不褪色,E中布条褪色;根据现象可得出的结论是干燥的Cl2没有漂白性.
④F中盛有NaOH溶液,其作用是吸收氯气,防止环境污染,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为0.1mol.
(2)探究铁丝在Cl2中燃烧的产物
某同学认为,当足量Cl2与少量铁丝反应时生成FeCl3,当少量Cl2与足量铁丝反应时生成FeCl2.为检验该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物配制成溶液A、B,并取溶液进行以下实验,请填写下表中的空格.
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中滴加2滴①KSCN溶液 | ②两份溶液都变血红色 | 生成物中都有FeCl3 |
| 分别向A、B溶液中滴加几滴KMnO4溶液 | 两份溶液颜色均无明显变化 | 生成物中都不含③FeCl2 |
| A. | NaHC03 | B. | CaC03 | C. | Al(OH)3 | D. | NaOH |
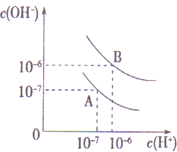 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: