题目内容
7.下列判断错误的是( )| A. | 常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L | |
| B. | 相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 | |
| C. | 标准状况下,44.8 L NO与22.4 L O2充分反应后得到的气体分子数小于2NA | |
| D. | 在常温常压下,2.24 L SO2与O2的混合气体中所含氧原子数为0.2NA |
分析 A、NO2、N2O4中存在平衡:2NO2?N2O4,反应放热;
B、相同物质的量的CO和氢气消耗相同量的氧气;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少;
D、常温常压下气体摩尔体积大于22.4L/mol.
解答 解:A、NO2、N2O4中存在平衡:2NO2?N2O4,反应放热,故降低温度后,平衡右移,则体积小于22.4L,故A正确;
B、相同物质的量的CO和氢气消耗相同量的氧气,在相同条件下,1 L CO和H2的物质的量相同,则消耗氧气的物质的量相同,均为0.5L,故B正确;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故分子个数小于2NA个,故C正确;
D、常温常压下气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则氧原子的个数小于0.2NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
6.下列说法正确的是( )
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 标况下O2的体积取决于O2分子间的距离 | |
| C. | 常温常压下4.9LO3含有的O约为9.6g | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |
7.在pH=1溶液中能大量共存的离子组是( )
| A. | Al3+、Ag+、NO${\;}_{3}^{-}$、Cl- | B. | Mg2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、K+、S2-、Cl- | D. | Fe2+、Na+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
15.欲将细口瓶中的液体药品倒入试管中,下列操作错误的是( )
| A. | 瓶塞正放在桌面上 | B. | 试管稍微倾斜 | ||
| C. | 标签朝向手心 | D. | 瓶口紧挨试管口 |
2.美国探测发现,在土卫六上的碳氢化合物储量是地球上的几百倍.对此,有关说法不正确的是( )
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
12.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成:其中○表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见下图),硅原子与氧原子的个数之比为( )
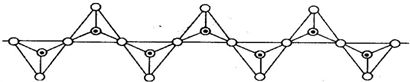

| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
19.乙酸松油酯的结构式如图所示,下列说法错误的是( )
 |
| 乙酸松油酯的结构式 |
| A. | 松油醇的分子式为C10H16O | |
| B. | 乙酸松油酯在NaOH溶液加热条件下得到的醋酸钠和松油醇 | |
| C. | 乙酸松油酯能发生加聚反应 | |
| D. | 乙酸松油酯能发生加成反应也能发生取代反应 |
16. 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
17.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).
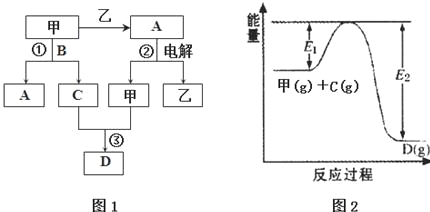
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;
填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
填写表中空格:②v正<v逆 ③v正>v逆.