题目内容
5.将铝粉和某铁的氧化物粉末混合均匀后再均分为两等分.一份直接放入足量的烧碱溶液中充分反应;另一份在高温下恰好完全反应后再与足量的稀H2SO4反应.上述两种情况下生成的气体的质量比为4:3,则该铁的氧化物为( )| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | 无法确定 |
分析 把铝粉和某铁氧化物粉末分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Fe与盐酸反应生成FeCl2与H2,另一份直接加入足量的NaOH溶液分反应生成偏铝酸钠与氢气,前后两种情况下生成的气体质量比是4:3,设氢气物质的量分别为4mol、3mol,根据电子转移守恒计算n(Fe)、n(Al),再根据Fe元素总物质的量及电子转移守恒列方程计算.
解答 解:设铁的氧化物是FexOy,每一份铁的氧化物是1mol,则反应产生金属铁的物质的量是xmol,若金属铝是amol,根据电子守恒得到3a=2y,根据方程式得到:$\frac{3a}{2}$:x=4:3,解得x=$\frac{9a}{8}$,所以x:y=3:4,所以是四氧化三铁,
故选C.
点评 本题考查混合物的计算,难度中等,清楚反应过程是关键,注意混合物的计算中守恒的运用,注意运用赋值法简化计算.

练习册系列答案
相关题目
15.欲将细口瓶中的液体药品倒入试管中,下列操作错误的是( )
| A. | 瓶塞正放在桌面上 | B. | 试管稍微倾斜 | ||
| C. | 标签朝向手心 | D. | 瓶口紧挨试管口 |
16. 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
13.分子式为C6H12,分子结构中含有3个“CH3”原子团的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO42Na2O2+2SO3=2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
17.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).
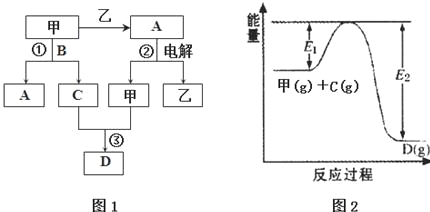
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;
填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
填写表中空格:②v正<v逆 ③v正>v逆.
14.将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )
| A. | KCl | B. | KBr | C. | CCl4 | D. | I2 |