题目内容
4. 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )| A. | 惰性电极a为发生氧化反应 | |
| B. | Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解 | |
| C. | 溶液Y加热蒸发灼烧最终得到Fe2O3 | |
| D. | 电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑ |
分析 H2S通入FeCl3溶液,二者之间发生氧化还原反应得到单质硫和氯化亚铁、盐酸的混合溶液,对混合液进行电解,根据电解池的工作原理进行回答即可.
解答 解:H2S通入FeCl3溶液,二者之间发生氧化还原反应得到单质硫和氯化亚铁、盐酸的混合溶液,对混合液进行电解,在阴极上产生的是氢气,所以电极b是阴极,a是阳极;
A、惰性电极a为阳极,该电极上发生氧化反应,故A正确;
B、电解后在阳极池得到的X是FeCl3,Fe(OH)3胶体中滴加溶液氯化铁,会出现沉淀,故B错误;
C、溶液Y是氯化亚铁,加热蒸发灼烧最终得到Fe2O3,故C正确;
D、在阴极上产生的是氢气,阳极上亚铁离子离子失电子得到的是铁离子,电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑,故D正确.
故选B.
点评 本题考查学生原电池和电解池的工作原理知识,注意氧化还原反应在解题中的作用是关键,难度中等.

练习册系列答案
相关题目
3.核磁共振氢谱是测定有机分子结构最有用的工具之一.在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同.根据峰值(信号)可以确定有机物中氢原子的种类.下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是( )
| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
15.欲将细口瓶中的液体药品倒入试管中,下列操作错误的是( )
| A. | 瓶塞正放在桌面上 | B. | 试管稍微倾斜 | ||
| C. | 标签朝向手心 | D. | 瓶口紧挨试管口 |
12.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成:其中○表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见下图),硅原子与氧原子的个数之比为( )
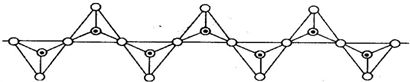

| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
19.乙酸松油酯的结构式如图所示,下列说法错误的是( )
 |
| 乙酸松油酯的结构式 |
| A. | 松油醇的分子式为C10H16O | |
| B. | 乙酸松油酯在NaOH溶液加热条件下得到的醋酸钠和松油醇 | |
| C. | 乙酸松油酯能发生加聚反应 | |
| D. | 乙酸松油酯能发生加成反应也能发生取代反应 |
9.下图是常用的化学仪器,其中常用于物质的分离与提纯的是( )
| A. |  | B. |  | C. |  | D. |  |
16. 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
13.分子式为C6H12,分子结构中含有3个“CH3”原子团的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )
| A. | KCl | B. | KBr | C. | CCl4 | D. | I2 |