题目内容
将1.95g锌粉加入到200mL的0.100mol?L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A、M |
| B、M2+ |
| C、M3+ |
| D、MO2+ |
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:n(Zn)=
=0.03mol,n(MO2+)=0.2L×0.1mol/L=0.02mol,Zn失去电子,M得到电子,结合电子守恒计算.
| 1.95g |
| 65g/mol |
解答:
解:n(Zn)=
=0.03mol,n(MO2+)=0.2L×0.1mol/L=0.02mol,
Zn失去电子,M得到电子,设还原产物中M的化合价为x,
由电子守恒可知,0.03mol×(2-0)=0.02mol×(5-x),
解得x=2,
故选B.
| 1.95g |
| 65g/mol |
Zn失去电子,M得到电子,设还原产物中M的化合价为x,
由电子守恒可知,0.03mol×(2-0)=0.02mol×(5-x),
解得x=2,
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A、NaOH、H2SO4、Na2SO4 |
| B、NaOH、AgNO3、H2SO4 |
| C、HCl、CuBr2、Ba(OH)2 |
| D、KBr、H2SO4、Ba(OH)2 |
某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5s的平均速率v(A)=0.03mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.40mol A、0.40mol B和0.10mol C,反应达到平衡前v(正)<v(逆) |
下列关于有机物的说法中错误的是( )
| A、CCl4可以由CH4制得,它可用于萃取碘水中的碘 |
| B、等物质的量的乙醇和乙烯完全燃烧时所需要的氧气质量相等 |
| C、用乙烯与HCl反应来制备1-氯乙烷比用乙烷与氯气反应更好 |
| D、苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 |
在相同条件下,0.1mol镁和0.1mol铝分别和足量的稀盐酸起反应后产生的氢气( )
| A、镁产生的多 |
| B、铝产生的多 |
| C、镁和铝产生的一样多 |
| D、无法比较 |
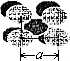 如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题:
如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题: