题目内容
某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5s的平均速率v(A)=0.03mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.40mol A、0.40mol B和0.10mol C,反应达到平衡前v(正)<v(逆) |
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算;
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
A、依据V(A)=
计算;
B、平衡状态A的物质的量为0.8mol,升高温度,平衡时c(A)=0.41mol?L-1,物质的量为0.82mol,物质的量增大,说明平衡逆向进行;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断.
D、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向.
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
A、依据V(A)=
| △c |
| △t |
B、平衡状态A的物质的量为0.8mol,升高温度,平衡时c(A)=0.41mol?L-1,物质的量为0.82mol,物质的量增大,说明平衡逆向进行;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断.
D、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向.
解答:
解:A的物质的量达到0.80mol反应达到平衡状态,则
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
K=
=0.625
A、反应在前5s的平均速率v(A)=
=0.015mol?L-1?s-1 ,故A错误;
B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,A物质的量为0.41mol/L×2L=0.82mol>0.80mol,说明升温平衡逆向进行,正反应是放热反应,则反应的△H<0,故B错误;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,转化率小于80%,故C错误;
D、相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,Qc=
=50>K,反应逆向进行,反应达到平衡前v(正)<v(逆),故D正确;
故选D.
A(g)+B(g)?C(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
K=
| ||||
|
A、反应在前5s的平均速率v(A)=
| ||
| 5s |
B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,A物质的量为0.41mol/L×2L=0.82mol>0.80mol,说明升温平衡逆向进行,正反应是放热反应,则反应的△H<0,故B错误;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,转化率小于80%,故C错误;
D、相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,Qc=
| ||||
|
故选D.
点评:本题考查了化学平衡计算应用,化学反应速率计算,平衡常数的计算分析应用是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
已知:3I2+6KOH═5KI+KIO3+3H2O.碘盐中加有KIO3,KIO3在工业上以石墨和铁为电极,用电解KI溶液方法制取,以下有关说法不正确的是( )
| A、电解时,石墨作阳极,铁作阴极 |
| B、阴极的电极反应式为:2H++2e-═H2↑ |
| C、电解过程中阳极周围溶液的pH变大 |
| D、理论上每生成1mol KIO3则电路中流过6mol电子 |
下列化学实验操作或事故处理方法不正确的是( )
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| B、浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
将1.95g锌粉加入到200mL的0.100mol?L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A、M |
| B、M2+ |
| C、M3+ |
| D、MO2+ |
下列平衡体系中,降温、加压都使平衡向右移动的是( )
| A、2HI(g)?H2(g)+I2(g)△H<0 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0 |
| C、C(s)+H20(g)?C0(g)+H2(g)△H>0 |
| D、2S03?2S0(g)+02(g)△H>0 |
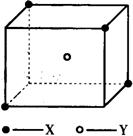 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: