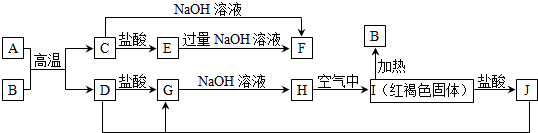
��Ŀ����
�Ի�ѧ��Ӧ���о���Ҫ�ӷ�Ӧ�������ȡ����ʡ�������ϵ�ȷ�������ۺϷ����������ǹ��ڻ�ѧ��Ӧ��һϵ���о�������������Ϣ�ش����⣮
���ڷ�Ӧ�ȵ��о�
��1����֪25��ʱ��H3PO4�ĵ��볣��Ϊ��Ka1=7.1��10-3��Ka2=6.3��10-8��Ka3=4.2��10-13�����Ʋ⣺NaH2PO4��Һ�� �ԣ���ᡱ��������С�����Na2HPO4�� �ԣ���ᡱ��������С�����
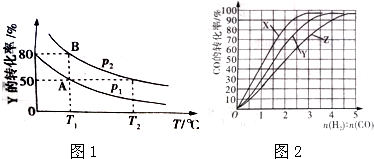
��2����һ�̶��ݻ����ܱ������м���X��Y��Z�������壬����һ���¶ȣ���ͬʱ�̲��X��Y��Z�������ʵ����ʵ������±���
��������Ӧ�Ļ�ѧ����ʽΪ ��
����һ�ݻ��ɱ���ܱ������г���20mol X��10mol Y��Y��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬Aʱ�����������Ϊ10L���練Ӧ��ʼʱ�Գ���20mol X��10mol Y������ƽ��״̬Bʱ���������V��B��= L��ͼ��P1��P2�Ĵ�С��ϵΪP1P2��
���ڷ�Ӧ��֮��Ķ�����ϵ���о�
��3���ں�3.2a mol HNO3��ϡ��Һ�У�����a mol ���ۣ���Ӧ�����ӷ���ʽΪ
��4����ҵ�ϳ����÷�Ӧ��CO��g��+2H2��g���TCH3OH��g����H��0 �ϳɼ״�������230��270���·�Ӧ��Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ���230�桢250���270�����ʵ�飬�����ͼ��ʾ����230��ʱ��ʵ��������Ӧ�������� �����¶��¹�ҵ�������˲��õĺϳ������n��H2����n��CO����ֵ��ȡֵ��Χ�ǣ�����ĸ��ţ� ��
A.1��1.5 B.2.5��3 C.3.5��4.5
���ڷ�Ӧ�ȵ��о�
��1����֪25��ʱ��H3PO4�ĵ��볣��Ϊ��Ka1=7.1��10-3��Ka2=6.3��10-8��Ka3=4.2��10-13�����Ʋ⣺NaH2PO4��Һ��
��2����һ�̶��ݻ����ܱ������м���X��Y��Z�������壬����һ���¶ȣ���ͬʱ�̲��X��Y��Z�������ʵ����ʵ������±���
| �ⶨʱ��/s | t1 | t2 | t3 | t4 |
| n��X��mol | 7 | 3 | 1 | 1 |
| n��Y��mol | 5 | 3 | 2 | 2 |
| n��z��mol | 1 | 3 | 4 | 4 |
����һ�ݻ��ɱ���ܱ������г���20mol X��10mol Y��Y��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬Aʱ�����������Ϊ10L���練Ӧ��ʼʱ�Գ���20mol X��10mol Y������ƽ��״̬Bʱ���������V��B��=
���ڷ�Ӧ��֮��Ķ�����ϵ���о�
��3���ں�3.2a mol HNO3��ϡ��Һ�У�����a mol ���ۣ���Ӧ�����ӷ���ʽΪ
��4����ҵ�ϳ����÷�Ӧ��CO��g��+2H2��g���TCH3OH��g����H��0 �ϳɼ״�������230��270���·�Ӧ��Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ���230�桢250���270�����ʵ�飬�����ͼ��ʾ����230��ʱ��ʵ��������Ӧ��������
A.1��1.5 B.2.5��3 C.3.5��4.5

���㣺��ѧƽ��ļ���,��ѧƽ�⽨���Ĺ���,ת�������¶ȡ�ѹǿ�ı仯����,���������ˮ��Һ�еĵ���ƽ��
ר�⣺�����������������
��������1������������ĵ����ˮ��̶ȵĴ�С�����жϣ�
��2���ٸ��ݲμӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�Ƚ��м��㣬��д�÷�Ӧ�Ļ�ѧ����ʽ��
������ѹǿ��ƽ�������ƶ���Y��ת��������ͬ���£�ץסƽ�ⳣ�������������ʽ���м��㣻
��3������ϡ����շ�Ӧ����ϡ�������ʱ��Ӧ����ʽ��Fe+4HNO3��ϡ��=Fe��NO3��3+NO��+2H2O����������ʱ��Ӧ����ʽ
3Fe+8H++2NO3-=3Fe2++4H2O+2NO������������ϡ��������Ĺ�ϵ���жϣ�
��4�����ݷ�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ��ת����ԽС����Ӧ��������ݺϳɰ��Ĺ�ҵ�Ʊ����ƣ�
��2���ٸ��ݲμӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�Ƚ��м��㣬��д�÷�Ӧ�Ļ�ѧ����ʽ��
������ѹǿ��ƽ�������ƶ���Y��ת��������ͬ���£�ץסƽ�ⳣ�������������ʽ���м��㣻
��3������ϡ����շ�Ӧ����ϡ�������ʱ��Ӧ����ʽ��Fe+4HNO3��ϡ��=Fe��NO3��3+NO��+2H2O����������ʱ��Ӧ����ʽ
3Fe+8H++2NO3-=3Fe2++4H2O+2NO������������ϡ��������Ĺ�ϵ���жϣ�
��4�����ݷ�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ��ת����ԽС����Ӧ��������ݺϳɰ��Ĺ�ҵ�Ʊ����ƣ�
���
�⣺��1��H2PO4-�ĵ��볣��ΪKa2=6.3��10-8��ˮ�ⳣ��ΪKw/K1=1.33��10-12���������ˮ�����������ԣ�HPO42-�ĵ��볣��ΪKa3=4.2��10-13��ˮ�ⳣ��ΪKw/K2=1.61��10-7��ˮ����ڵ��������Լ���
�ʴ𰸣���
��2���١�n��X������n��Y������n��Z������7-1������5-2������4-1��=6��3��3=2��1��1���μӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ��ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��2X+Y?Z��
�ʴ�Ϊ��2X+Y?Z��
������ѹǿ��ƽ�������ƶ���Y��ת��������p2ʱY��ת���ʴ���p1ʱ����p1��p2��
ƽ��A 2X+Y?Z��
��ʼ 20 10 0
ת�� 10 5 5
ƽ�� 10 5 5
��K=
=1
ƽ��B 2X+Y?Z��
��ʼ 20 10 0
ת�� 16 8 8
ƽ�� 4 2 8
������¶Ȳ���K����ã�K=
=1�����V=2L
�ʴ�Ϊ��2������
��3������ϡ����շ�Ӧ����ϡ�������ʱ��Ӧ����ʽ��Fe+4HNO3��ϡ��=Fe��NO3��3+NO��+2H2O����
��4ʱֻ��������������������ʱ��Ӧ����ʽ
3Fe+8H++2NO3-=3Fe2++4H2O+2NO������
��
ʱֻ��������������3.2a mol HNO3��ϡ��Һ�У�����a mol ���ۣ�
=3.2���պ�������֮��ʼ��ж������������������������Է�Ӧ�����ӷ���ʽΪ5Fe+16H++4NO3-=3Fe2++2Fe3++8H2O+4NO����
�ʴ𰸣�5Fe+16H++4NO3-=3Fe2++2Fe3++8H2O+4NO����
��4����ҵ���÷�Ӧ��ѹ�ϳɼ״�����230�桫270����Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ��ֱ���230�桢250���270�����ʵ�飬�����ͼ���ϳɼ״��Ƿ��ȷ�Ӧ���¶�Խ��ת����Խ���ͼ���֪��230���ʵ��������Ӧ�������� X������ҵ�������˲��õĺϳ�����ɱ�n��H2����n��CO���ķ�ΧӦ��Ӧ�� һ����̼��ת���ʴ�����������������һ����̼��ת���ʣ�����n��H2����n��CO����2��1��ѡ����������������С��ԭ�ϣ���ѡB��
�ʴ�Ϊ��X��B��
�ʴ𰸣���
��2���١�n��X������n��Y������n��Z������7-1������5-2������4-1��=6��3��3=2��1��1���μӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ��ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��2X+Y?Z��
�ʴ�Ϊ��2X+Y?Z��
������ѹǿ��ƽ�������ƶ���Y��ת��������p2ʱY��ת���ʴ���p1ʱ����p1��p2��
ƽ��A 2X+Y?Z��
��ʼ 20 10 0
ת�� 10 5 5
ƽ�� 10 5 5
��K=
| 0.5 |
| 0.5��1 2 |
ƽ��B 2X+Y?Z��
��ʼ 20 10 0
ת�� 16 8 8
ƽ�� 4 2 8
������¶Ȳ���K����ã�K=
| 8/V |
| (4/V)2��(2/V) |
�ʴ�Ϊ��2������
��3������ϡ����շ�Ӧ����ϡ�������ʱ��Ӧ����ʽ��Fe+4HNO3��ϡ��=Fe��NO3��3+NO��+2H2O����
| n(HNO 3) |
| n(Fe) |
3Fe+8H++2NO3-=3Fe2++4H2O+2NO������
| n(HNO 3) |
| n(Fe) |
| 8 |
| 3 |
| n(HNO 3) |
| n(Fe) |
�ʴ𰸣�5Fe+16H++4NO3-=3Fe2++2Fe3++8H2O+4NO����
��4����ҵ���÷�Ӧ��ѹ�ϳɼ״�����230�桫270����Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ��ֱ���230�桢250���270�����ʵ�飬�����ͼ���ϳɼ״��Ƿ��ȷ�Ӧ���¶�Խ��ת����Խ���ͼ���֪��230���ʵ��������Ӧ�������� X������ҵ�������˲��õĺϳ�����ɱ�n��H2����n��CO���ķ�ΧӦ��Ӧ�� һ����̼��ת���ʴ�����������������һ����̼��ת���ʣ�����n��H2����n��CO����2��1��ѡ����������������С��ԭ�ϣ���ѡB��
�ʴ�Ϊ��X��B��
����������ӷ�Ӧ�ȡ���Ӧ�����ȿ��黯ѧƽ������֪ʶ���ۺ��Խ�ǿ���ѶȽϴ�

��ϰ��ϵ�д�
 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
�����Ŀ
�ò��缫�����ԣ�������е������Һ������ʵ�Ũ����������Һ��pH������ǣ�������
| A��NaOH��Һ |
| B��CuSO4��Һ |
| C��Na2SO4��Һ |
| D��NaCl��Һ |
����ʵ����ƻ�ʵ������У���ȷ���ǣ�������
A��ͭ��Ũ���ᷴӦ��NO2���ɲ�����ͼװ�� |
| B������������Ҵ���Һ���÷�Һ©�����з��� |
| C��ϡ�����п����Ӧ��ȡ������������������ͭ�Լӿ췴Ӧ���� |
| D������Na2CO3��Һ��NaHCO3��Һ���ֱ���������Һ�μӳ���ʯ��ˮ������ |
�����ڼ���������Ҵ����ǣ�������
| A��ˮ | B���Ȼ�����Һ |
| C�����������Һ | D����ɫʯ����Һ |
��1.95gп�ۼ��뵽200mL��0.100mol?L-1MO2+��Һ�У�ǡ����ȫ��Ӧ����ԭ��������ǣ�������
| A��M |
| B��M2+ |
| C��M3+ |
| D��MO2+ |