题目内容
6.(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表
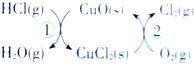 示).
示).(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
分析 (1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;
(2)①随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=$\frac{△c}{△t}$计算得到;20s到40s的平均速率为:$\frac{0.12-0.08}{40}$=0.001mol/L,而随时间的推移浓度减少,反应速率减慢,所以40s时C2 大于0.10mol/L;
②N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
③计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答 解:(1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,
反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,
根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),
故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2);
(2)①随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=$\frac{0.06mol/L}{60s}$=0.0010mol•L-1•s-1;而随时间的推移浓度减少,反应速率减慢,所以40s时C2 大于0.10mol/L,
故答案为:>;0.0010mol•L-1•s-1;>;
②N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高;
③平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,K2=$\frac{(0.16mol/L)^{2}}{0.020mol/L}$=1.28mol/L,故答案为:1.28mol/L;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,N2O4的转化率减小,故答案为:逆反应;减小.
点评 本题考查化学平衡表格、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大.

| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 盛放烧碱溶液的试剂瓶不能用玻璃塞,是因为:SiO2+2OH-═SiO32-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
| A. | 脱落酸 | B. | 乙烯 | C. | 生长素 | D. | 甲烷 |
| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 质子数. |
| A. | 标况下,11.2升CCl4中含有氯原子的数目为2 NA | |
| B. | 500mL 0.5mol/L的Na2CO3溶液中,含有CO32-的数目小于0.25NA | |
| C. | 常温下电解NaNO3溶液,当阳极产生气体22.4升时,转移电子的数目为4NA | |
| D. | 将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
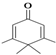 如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )
如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )| A. | Penguinone中存在两种官能团 | |
| B. | Penguinone是一种芳香醛 | |
| C. | Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质 | |
| D. | 如果该分子中的双键都能加成,则1 mol Penguinone能与3 mol氢气反应 |
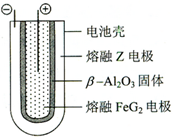 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.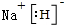 ;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式).
;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式). Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.