题目内容
1.下列反应的离子方程式书写中,正确的是( )| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 盛放烧碱溶液的试剂瓶不能用玻璃塞,是因为:SiO2+2OH-═SiO32-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.二氧化碳过量,反应生成碳酸氢根离子;
C.二氧化硅与氢氧化钠反应生成硅酸钠和水;
D.氨水为弱碱,二者反应生成氢氧化铝沉淀和氯化铵.
解答 解:A.氯气溶于水生成氯化氢和次氯酸,反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故A错误;
B.向NaAlO2溶液中通入过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.盛放烧碱溶液的试剂瓶不能用玻璃塞,是因为二氧化硅与氢氧化钠发生反应:SiO2+2OH-═SiO32-+H2O,故C正确;
D.氯化铝溶液中加入过量的氨水,反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
11.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
| A. | ②③④⑤⑥⑦ | B. | ①③④⑤ | C. | ①②③④⑤⑦ | D. | ①③⑤ |
9.下列各物质中,不能由化合反应得到的是( )
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
16.下列离子方程式,只能表示一个化学反应的是( )
①CO32-+2H+═CO2↑+H2O
②OH-+H+═H2O
③Ag++Cl-═AgCl↓
④Fe+Cu2+═Fe2++Cu
⑤Cl2+H2O═H++Cl-+HClO.
①CO32-+2H+═CO2↑+H2O
②OH-+H+═H2O
③Ag++Cl-═AgCl↓
④Fe+Cu2+═Fe2++Cu
⑤Cl2+H2O═H++Cl-+HClO.
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | 只有⑤ |
6.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 正常雨水的pH值为7.0,酸雨的pH值小于7.0 | |
| B. | 亚硝酸盐常做食品防腐剂,可以大量添加于食物中 | |
| C. | 自然界中的固氮作用对植物的生长有害无益 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的重要原因之一 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气中氯原子数为NA | |
| B. | 标准状况下,22.4LNH3所含的电子数为10NA | |
| C. | 5.6gFe在足量氯气中燃烧转移的电子数为2NA | |
| D. | 标准状况下,11.2L H2O中含有分子的数目为0.5NA |
10.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 清晨的雾 | B. | 盐水 | C. | 蔗糖溶液 | D. | 浑浊泥水 |
6.(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表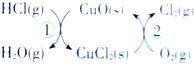 示).
示).
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表
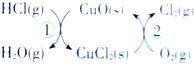 示).
示).(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |