题目内容
18.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标况下,11.2升CCl4中含有氯原子的数目为2 NA | |
| B. | 500mL 0.5mol/L的Na2CO3溶液中,含有CO32-的数目小于0.25NA | |
| C. | 常温下电解NaNO3溶液,当阳极产生气体22.4升时,转移电子的数目为4NA | |
| D. | 将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
分析 A、标况下四氯化碳为液体;
B、碳酸根是弱酸根,在溶液中会水解;
C、在常温下,气体摩尔体积大于22.4L/mol;
D、合成氨的反应为可逆反应.
解答 解:A、标况下四氯化碳为液体,故不能根据其体积来计算其物质的量和含有的氯原子个数,故A错误;
B、碳酸根是弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于0.25NA个,故B正确;
C、电解硝酸银溶液,阳极生成的气体为氧气,而常温常压下气体摩尔体积大于22.4L/mol,故阳极生成的氧气的物质的量小于1mol,则转移的电子数小于4NA个,故C错误;
D、合成氨的反应为可逆反应,故不能进行彻底,则得到的氨气分子个数小于0.2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气中氯原子数为NA | |
| B. | 标准状况下,22.4LNH3所含的电子数为10NA | |
| C. | 5.6gFe在足量氯气中燃烧转移的电子数为2NA | |
| D. | 标准状况下,11.2L H2O中含有分子的数目为0.5NA |
14.将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |
6.(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表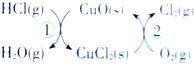 示).
示).
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表
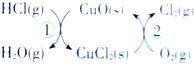 示).
示).(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
13.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值增大的是( )
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
3.氮氧化物与悬浮在大气中的海盐粒子会发生下列反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+C l2(g),△H在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡,此时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
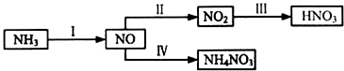
8.NH3经一系列反应可以得到HNO3,如图所示.
(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
②往上述平衡体系中充入氩气,此时v (N2)正减小(填“增大”、“减小”或“不变”)
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:
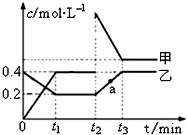
①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,
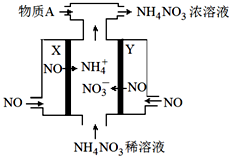
总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)

(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:

①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,

总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)




 .
. 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.