题目内容
19.在同温同压下,1mol F2和1mol I2具有相同的( )| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 质子数. |
分析 由n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$可知,在同温同压下,1mol F2和1mol I2具有相同的体积和分子数,同为双原子分子,因此原子数相等,每个H和F含有的质子数不同,因此质子数不同,
由n=$\frac{m}{M}$可知,M不同,所以质量不同.
解答 解:由n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$可知,在同温同压下,1mol F2和1mol I2具有相同的体积和分子数,同为双原子分子,因此原子数相等,每个H和F含有的质子数不同,因此质子数不同,由n=$\frac{m}{M}$可知,M不同,所以质量不同,因此1mol F2和1mol I2具有相同的体积、原子数,
故选AB.
点评 本题考查了物质的量的有关计算,灵活运用物质的量有关公式解答即可,难度不大,注意气体摩尔体积的适用范围及适用条件.

练习册系列答案
相关题目
9.下列各物质中,不能由化合反应得到的是( )
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
10.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 清晨的雾 | B. | 盐水 | C. | 蔗糖溶液 | D. | 浑浊泥水 |
14.将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |
4.X,Y,Z为原子序数依次增大的短周期元素,且最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的2倍.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | 工业上可通过电解Y的盐溶液来制备Y的单质 | |
| D. | 氧元素分别与X、Y、Z形成的化合物都不止一种 |
6.(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表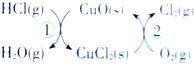 示).
示).
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
反应①2HCl(g)+CuO(s)═H2O(g)+CuCl2(s)△H1
反应②生成1molCl2(g)的反应热为△H2,
则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热△H用含△H1和△H2的代数式表
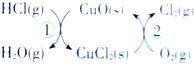 示).
示).(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
①该反应的△H>0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示.在0~60s时段,反应速率v(N2O4)为0.001mol•L-1•s-1;40s时C2>0.10mol/L(填“>”或“<”).
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.则T>100℃(填“>”或“<”).
③计算温度T时反应的平衡常数K=1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向逆反应(填“正反应”或“逆反应”)方向移动,N2O4的转化率减小(填“增大”或“减小”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
3.氮氧化物与悬浮在大气中的海盐粒子会发生下列反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+C l2(g),△H在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡,此时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.