题目内容
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA |
| B、常温常压下,16g O3所含的电子数为8NA |
| C、0.1mol Na2O2晶体中含有0.4NA个离子 |
| D、铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.二氧化氮与四氧化二氮存在转化平衡,导致气体的分子数减小;
B.16g臭氧中含有16g氧原子,含有1mol氧原子,1mol氧原子含有8mol电子;
C.过氧化钠中的离子为钠离子和过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有0.3mol离子;
D.生成1mol氢气需要转移2mol电子.
B.16g臭氧中含有16g氧原子,含有1mol氧原子,1mol氧原子含有8mol电子;
C.过氧化钠中的离子为钠离子和过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有0.3mol离子;
D.生成1mol氢气需要转移2mol电子.
解答:
解:A.标况下,11.2L气体的物质的量为0.5mol,0.5mol一氧化氮消耗0.25mol氧气生成0.5mol二氧化氮,氧气剩余0.25mol,由于部分二氧化氮转化成四氧化二氮,所以反应后的气体的物质的量小于0.75mol,所含分子数小于0.75NA,故A错误;
B.16g臭氧中含有16g氧原子,含有氧原子的物质的量为1mol,含有8mol电子,所含的电子数为8NA,故B正确;
C.0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有阴阳离子总物质的量为0.3mol,含有0.3NA个离子,故C错误;
D.生成1mol氢气,得到了2mol电子,根据电子守恒,转移了2mol电子,转移的电子数为2NA,故D错误;
故选B.
B.16g臭氧中含有16g氧原子,含有氧原子的物质的量为1mol,含有8mol电子,所含的电子数为8NA,故B正确;
C.0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有阴阳离子总物质的量为0.3mol,含有0.3NA个离子,故C错误;
D.生成1mol氢气,得到了2mol电子,根据电子守恒,转移了2mol电子,转移的电子数为2NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项A为易错点,注意二氧化氮与四氧化二氮之间存在转化平衡.

练习册系列答案
相关题目
下列排列的顺序不正确的是( )
| A、热稳定性:HCl>PH3>H2S |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、原子半径:Na>S>O |
| D、结合氢离子能力:CO32->HCO3->SO42- |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述正确的是( )
| A、放电时,负极反应式为3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时,正极区溶液的pH减小 |
| C、充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、充电时,电池的锌电极接电源的正极 |
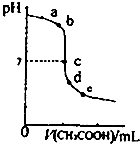 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4则60mol CuSO4能氧化白磷的物质的量是( )
| A、3mol | B、6mol |
| C、11mol | D、12mol |
在塑料原料加工时,添加塑化剂(DCHP)可以使其变得较为柔软,易于加工.塑化剂易溶于有机溶剂,是一种对人体有害的一类物质.塑化剂的一种制备方法如下:

下列说法正确的是( )

下列说法正确的是( )
| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
下列说法正确的是( )
| A、苯酚显酸性,是因为羟基对苯环影响的结果 |
| B、分子式为C2H4和C3H6的物质一定互为同系物 |
C、聚合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 |
D、1mol 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH |
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |