题目内容
白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4则60mol CuSO4能氧化白磷的物质的量是( )
| A、3mol | B、6mol |
| C、11mol | D、12mol |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,结合电子守恒来解答.
解答:
解:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,
则由电子守恒可知,有60mol的CuSO4参加反应,60molCuSO4得到60mol电子,1molP4参加反应失去20mol电子,所以60molCuSO4能氧化白磷的物质的量是
=3mol,
故选A.
则由电子守恒可知,有60mol的CuSO4参加反应,60molCuSO4得到60mol电子,1molP4参加反应失去20mol电子,所以60molCuSO4能氧化白磷的物质的量是
| 60 |
| 20 |
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA |
| B、在常温下,若CO与CO2的体积相等,则它们的物质的量相等 |
| C、标准状况下,22.4L NO与CO2的混合气体中含有O的原子数为3NA |
| D、在常温常压下,22.4L氢气的质量为2g |
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.下列说法不正确的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化,2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
下列有机物命名正确的是( )
A、 2-乙基丙烷 2-乙基丙烷 |
| B、2-甲基丙烯 (CH3)2C=CH2 |
C、1,3,4-三甲苯  |
| D、2,2-二甲基-3-丁醇 (CH3)3C-CHOH-CH3 |
霉酚酸酯(结构如图)是器官移植中抑制细胞增殖最常用的药物.下列说法正确的是( )
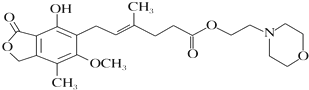

| A、霉酚酸酯能溶于水 |
| B、霉酚酸酯能与浓溴水发生取代反应 |
| C、1mol霉酚酸酯能与含4mol NaOH的水溶液完全反应 |
| D、霉酚酸酯既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA |
| B、常温常压下,16g O3所含的电子数为8NA |
| C、0.1mol Na2O2晶体中含有0.4NA个离子 |
| D、铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
 如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )
如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )| A、此图是1.0mol/L碳酸钠溶液滴定1.0mol/L HCl溶液的滴定曲线 |
| B、在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在 |
| D、若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上 |
用如图装置进行相应实验,不能达到实验目的是( )


| A、图1所示装置可制备氢氧化亚铁 |
| B、图2所示装置可电解食盐水制氯气和氢气 |
| C、图3所示装置可验证氨气极易溶于水 |
| D、图4所示装置与操作可除去苯中的苯酚 |
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题: