题目内容
14.恒温恒容NO2(g)+SO2(g)?SO3(g)+NO(g),测得反应体系中NO2、SO2气体的体积分数Φ(NO2)、Φ(SO2)与反应时间t的关系如下表:| t/min | t0 | t1 | t2 | t3 | t4 | t5 |
| Φ(NO2) | $\frac{1}{3}$ | 0.30 | $\frac{4}{15}$ | $\frac{1}{6}$ | $\frac{1}{15}$ | $\frac{1}{15}$ |
| Φ(SO2) | $\frac{2}{3}$ | $\frac{19}{30}$ | 0.60 | 0.50 | 0.40 | 0.40 |
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
分析 ①可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
②平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$,反应前后气体分子数目不变,可以用物质的量代替浓度计算平衡常数,物质的量可以用体积分数代替;
③可逆反应到达平衡时正逆速率相等.
解答 解:①a.反应前后气体总物质的不变,恒温恒容下,体系压强为定值,故a错误;
b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明反应到达平衡,故b正确;
c.反应的焓变与条件及化学计量数有关,条件不变,反应中的焓变保持不变,故c错误;
d.每消耗1mol SO3同时生成1 mol SO2,均表示逆反应速率,反应开始后始终按该比例关系进行,不能说明到达平衡,而每消耗1mol SO3同时消耗1 mol SO2时,反应到达平衡状态,故d错误,
故选:b;
②平衡时Φ(SO3)=Φ(NO)=(1-0.4-$\frac{1}{15}$)×$\frac{1}{2}$=$\frac{4}{15}$,反应前后气体分子数目不变,可以用物质的量代替浓度计算平衡常数,物质的量可以用体积分数代替,故平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$=$\frac{\frac{4}{15}×\frac{4}{15}}{\frac{6}{15}×\frac{1}{15}}$=$\frac{8}{3}$,
故答案为:$\frac{8}{3}$;
③平衡时正逆反应速率相等,故k正Φ(NO2)Φ(SO2)=k逆Φ(SO3)Φ(NO),则k正=K•k逆,
故答案为:K•k逆.
点评 本题考查化学平衡有关计算,侧重对化学平衡常数的考查,注意化学平衡常数只受温度影响,平衡常数表达式及其单位与化学计量数有关.

 阅读快车系列答案
阅读快车系列答案| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
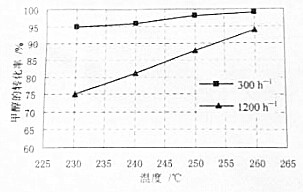 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 


 .
. .
.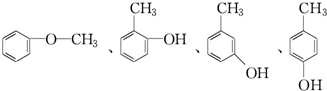 .
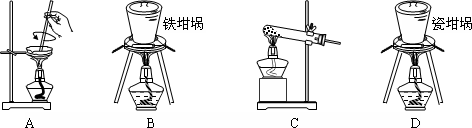
.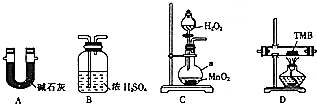 由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.