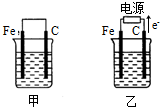
题目内容
2.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下.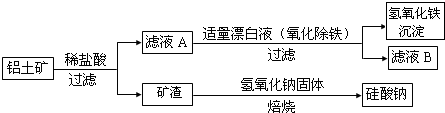
(1)在滤液A中加入漂白液,目的是氧化除铁,便于后期形成Fe(OH)3沉淀,所得滤液B显酸性.
①检验滤液A中含有Fe3+的试剂为KSCN溶液或者硫氰化钾溶液
②检验滤液B中不含有Fe2+的实验操作方法为取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含铁元素.
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为d(填选项编号).
a.氢氧化钠溶液 b.硫酸溶液 c.二氧化碳 d.氨水
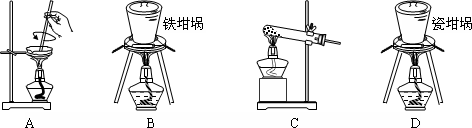
(2)矿渣中一定含有的物质是SiO2(填化学式).焙烧制备硅酸钠,可采用的装置为B(填选项编号).
分析 图示工艺流程为:铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液中含有铁离子、亚铁离子和氯离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硅与氢氧化钠在铁坩埚中焙烧生成硅酸钠,
(1)①检验是否含铁离子,可加入KSCN溶液;
②可先加入KSCN,在加入氯水;
③滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱碱选择;
(3)玻璃、瓷坩埚中含有二氧化硅,可与氢氧化钠在加热条件下反应.
解答 解:图示工艺流程为:铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液中含有铁离子、亚铁离子和氯离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硅与氢氧化钠在铁坩埚中焙烧生成硅酸钠,
(1)①检验是否含铁离子,可加入KSCN溶液,如溶液变红色,可说明含有铁离子,故答案为:KSCN溶液或者硫氰化钾溶液;
②滤液B可能含有铁离子或亚铁离子,可取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含铁元素,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含铁元素;
③滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出,
a.氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,氢氧化钠不是最佳试剂,故a错误;
b.硫酸溶液不与铝离子反应,故b错误;
c.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故c错误;
d.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故d正确;
故答案为:d;
(2)二氧化硅与盐酸不反应,矿渣中一定含有的物质是SiO2,
A.蒸发皿中含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故A错误;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,可在铁坩埚中用SiO2和NaOH焙烧制备硅酸钠,故B正确;
C.玻璃中含二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故C错误;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故D错误;
故答案为:SiO2;B.
点评 本题考查了物质制备方案的设计、常见物质的分离与提纯方法的综合应用,题目难度中等,明确制备工艺流程及反应原理为解答关键,注意掌握化学实验基本操作方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | NaCl | B. | MgCl2 | C. | Na2O | D. | NaOH |
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| t/min | t0 | t1 | t2 | t3 | t4 | t5 |
| Φ(NO2) | $\frac{1}{3}$ | 0.30 | $\frac{4}{15}$ | $\frac{1}{6}$ | $\frac{1}{15}$ | $\frac{1}{15}$ |
| Φ(SO2) | $\frac{2}{3}$ | $\frac{19}{30}$ | 0.60 | 0.50 | 0.40 | 0.40 |
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |