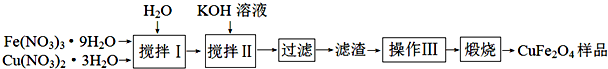
题目内容
9.塑化剂是工业上被广泛使用的高分子材料助剂,在塑料加工中添加这种物质,可以使其柔韧性增强,容易加工.塑化剂可合法用于工业生产,但禁止作为食品添加剂.截止2011年6月8日,台湾被检测出含塑化剂食品已达961种,据媒体报道,2012年岁末,我国大陆多种著名品牌白酒也陷入了塑化剂风波.常见塑化剂为邻苯二甲酸酯类物质,某有机物J(C19H20O4)是一种塑料工业中常用的塑化剂,可用下列合成路线合成.
已知:Ⅰ.
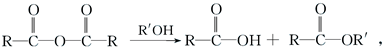

Ⅱ.控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应;
Ⅲ.F与浓溴水混合不产生白色沉淀.
请回答下列问题:
(1)E中官能团的名称为氯原子;F中官能团的电子式为
 .
.(2)写出A+F→J的化学方程式:
 .
.(3)写出下列化学反应类型:反应①取代反应;反应④取代反应.
(4)写出F的属于芳香烃衍生物的同分异构体的结构简式:
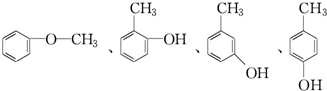 .
.(5)C4H9OH的同分异构体中属于醇类的有4种,写出其中具有手性碳的同分异构体的结构简式:CH3CH2CH(OH)CH3.
分析 D为苯的同系物,且与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式C7H7,可推得D为 、E为
、E为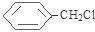 、F为
、F为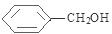 .根据信息可知反应①是取代反应,则A的结构简式为
.根据信息可知反应①是取代反应,则A的结构简式为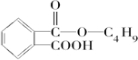 ;反应④为酯化反应,则J为
;反应④为酯化反应,则J为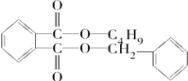 ,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ,B与E(
,B与E( )发生取代反应生成J.
)发生取代反应生成J.
解答 解:D为苯的同系物,且与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式C7H7,可推得D为 、E为
、E为 、F为
、F为 .根据信息可知反应①是取代反应,则A的结构简式为式为
.根据信息可知反应①是取代反应,则A的结构简式为式为 ;反应④为酯化反应,则J为
;反应④为酯化反应,则J为 ,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ,B与E(
,B与E( )发生取代反应生成J.
)发生取代反应生成J.
(1)根据分析可知,E为 ,E中的官能团为氯原子,F的结构简式为:
,E中的官能团为氯原子,F的结构简式为: ,F中官能团为-OH,羟基的电子式为
,F中官能团为-OH,羟基的电子式为 ,
,
故答案为:氯原子; ;
;
(2)A+F→J的化学方程式为 ,
,
故答案为: ;
;
(3)根据上面的分析可知,反应①为取代反应,反应④为取代反应,
故答案为:取代反应;取代反应;
(4)F为 ,F的属于芳香烃衍生物的同分异构体的结构简式为
,F的属于芳香烃衍生物的同分异构体的结构简式为 ,
,
故答案为: ;
;
(5)C4H9OH的同分异构体中属于醇类的有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2C(OH)CH3、(CH3)2CHCH2OH,共4种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3,
故答案为:4;CH3CH2CH(OH)CH3.
点评 本题考查有机的推断与合成,注意根据转化中有机物结构特点进行推断,熟练掌握官能团的结构与性质,注意对题目信息的应用,是对有机化学基础的综合考查,难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
16.常温下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图.下列分析正确的是( )
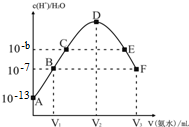

| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
13.已知C8H11N的同分异构体中含有苯环的有很多种(不考虑立体异构),苯环上有一个侧链,二个侧链和三个侧链的种数分别是( )
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
4.大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱
硝)后才能排放.
(1)已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1 ①
N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1 ②
CH4可用于硝,其热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H3 ③
已知反应①中的相关的化学键键能数据如下:
由此计算△H3=-1150kJ.mol-1,C-H化学键键能E=414kJ.mol-1.
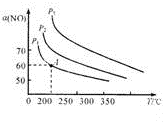
(2)反应2CO (g)+2NO(g)═N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中
NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=4.22(mol/L)-1,图中压强(P1、P2、P3)的大小顺序为P3>P2>P1.
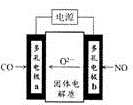
(3)有人利用电化学方法将CO和NO转化为无毒物质.装置如图2所示
①电极a是阳极;
②电极b的电极反应式是2NO+4e-═N2+2O2-.
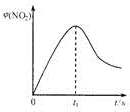
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO.的体积分数下降,其可能的原因是该反应是放热反应研究小组通过增大$\frac{n({O}_{3})}{n(NO)}$比值提高NO的平衡转化率,却发现当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物(或生成了N2O5).
硝)后才能排放.
(1)已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1 ①
N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1 ②
CH4可用于硝,其热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H3 ③
已知反应①中的相关的化学键键能数据如下:
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
(2)反应2CO (g)+2NO(g)═N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中
NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=4.22(mol/L)-1,图中压强(P1、P2、P3)的大小顺序为P3>P2>P1.
 |  |  |
| 图1 | 图2 | 图3 |
①电极a是阳极;
②电极b的电极反应式是2NO+4e-═N2+2O2-.
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO.的体积分数下降,其可能的原因是该反应是放热反应研究小组通过增大$\frac{n({O}_{3})}{n(NO)}$比值提高NO的平衡转化率,却发现当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物(或生成了N2O5).
14.恒温恒容NO2(g)+SO2(g)?SO3(g)+NO(g),测得反应体系中NO2、SO2气体的体积分数Φ(NO2)、Φ(SO2)与反应时间t的关系如下表:
①下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
| t/min | t0 | t1 | t2 | t3 | t4 | t5 |
| Φ(NO2) | $\frac{1}{3}$ | 0.30 | $\frac{4}{15}$ | $\frac{1}{6}$ | $\frac{1}{15}$ | $\frac{1}{15}$ |
| Φ(SO2) | $\frac{2}{3}$ | $\frac{19}{30}$ | 0.60 | 0.50 | 0.40 | 0.40 |
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
18.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
19.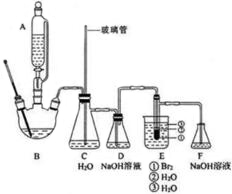 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
装置B中发生的反应为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
合成反应:
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀地到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分装入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,使管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验室没有装置D
c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.装置B中发生的反应为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀地到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分装入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,使管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验室没有装置D
c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.