题目内容
13.下列说法不正确的是( )| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
分析 A、电解池的反应是属于非自发进行的氧化还原反应;
B、参加反应的物质越多,放出热量越多;
C、根据化学反应过程中的能量变化形式分析;
D、热化学方程式中的化学计量数只表示物质的量,可以是分数.
解答 解:A、电解池的反应是属于非自发进行的氧化还原反应,故A错误;
B、参加反应的物质越多,放出热量越多,所以化学反应热效应数值与参加反应的物质多少有关,故B正确;
C、根据化学反应过程中的能量转化形式分析,除了热能外,也可以是光能、电能等,故C正确;
D、热化学方程式中的化学计量数只表示物质的量,可以是分数,故D正确.
故选:A.
点评 本题主要考查了放热与吸热反应的原因、常见的吸热和放热反应、反应自发进行的判断依据应用,原电池、电解池原理是理解解题关键,是对基本知识的考查,较简单.

练习册系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 煤经气化和液化等物理变化可转化为清洁燃料 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 苯和油脂均不能使酸性髙锰酸钾溶液褪色 |
8.下列实验现象与对应结论均正确的是( )
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
18.下列有关电化学原理的说法中,不正确的是( )
| A. | 镀锌铁制品镀层受损后,铁制品也不容易生锈 | |
| B. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 将钢闸门与直流电源的负极相连,可降低钢闸门腐蚀速率 |
5.已知E1=134kJ•mol-1、E2=368kJ•mol-1,请参考题中图表,根据要求回答问题:
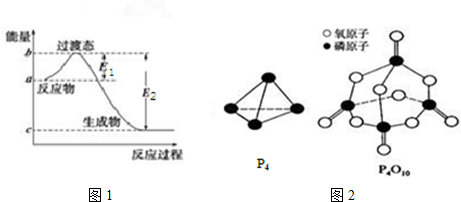
(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ•mol-1,白磷及其完全燃烧的产物的结构如图2所示,则表中x=$\frac{6a+5c+d-12b}{4}$kJ•mol-1(用含a、b、c、d的代表数式表示).

(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
2.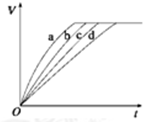 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
3.决定化学反应速率的根本因素是( )
| A. | 合适的催化剂 | B. | 温度和压强 | C. | 反应物的浓度 | D. | 反应物的性质 |