题目内容
8.下列实验现象与对应结论均正确的是( )| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.其他离子浓度相同;
B.钠离子的焰色反应呈黄色;
C.氯化银为白色沉淀;
D.常温下将Al片放入浓硝酸中发生钝化.
解答 解:A.其他离子浓度相同,H2C2O4浓度不同,可比较反应速率,故A正确;
B.用洁净铂丝蘸取无色溶液进行焰色反应,火焰呈黄色,则溶液中一定含有钠离子,可以为钠盐或者氢氧化钠,故B错误;
C.氯化银为白色沉淀,现象不正确,故C错误;
D.常温下将Al片放入浓硝酸中发生钝化,生成致密的氧化膜阻止反应的进一步发生,则观察不到明显现象,并不是不反应,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学反应速率、焰色反应、沉淀转化以及Al的钝化等,把握物质的性质及发生的化学反应、反应原理为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
18.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3分别为1mol/L和0.5mol/L,取10ml此混合酸,向其中加入过量的铁粉,反应结束后产生的气体在标准状况下的体积是(HNO3被还原成NO)( )
| A. | 0.168L | B. | 0.112L | C. | 0.672L | D. | 0.224L |
19.下列物质中可以用来鉴别己烯、四氯化碳、苯的是( )
| A. | 水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 液溴 | D. | NaOH溶液 |
16. 有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
 有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
13.下列说法不正确的是( )
| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
20.已知:①H2O(g)=H2O(l)△H1=-a kJ•mol-1
②C2H5OH(g)=C2H5OH(l)△H2=-b kJ•mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-c kJ•mol-1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
②C2H5OH(g)=C2H5OH(l)△H2=-b kJ•mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-c kJ•mol-1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | (b-a-c)kJ | B. | (3a-b+c )kJ | C. | (a-3b+c)kJ | D. | (b-3a-c)kJ |
17.下列实验装置正确且能完成实验目的是( )
| A. | 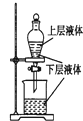 提取海带中的碘 | B. | 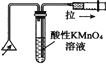 检验火柴燃烧产生的SO2 | ||
| C. | 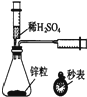 测定一定时间内生成H2的反应速率 | D. | 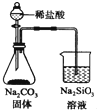 证明非金属性Cl>C>Si |
18.下列说法错误的是( )
| A. | 抗酸药能中和胃里过多的盐酸,是一类治疗胃痛的药 | |
| B. | 碳酸镁、碳酸钡都能制成抗酸药物 | |
| C. | 青霉素过敏严重者会导致死亡,故用药前要进行皮肤敏感试验 | |
| D. | 青霉素是最重要的消炎药 |
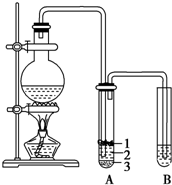 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: