题目内容
5.已知E1=134kJ•mol-1、E2=368kJ•mol-1,请参考题中图表,根据要求回答问题: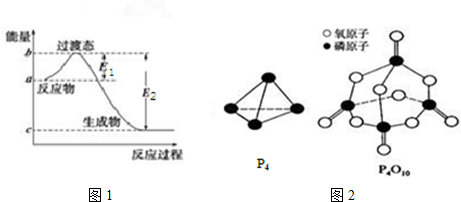
(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
分析 (1)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算.
解答 解:(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,
x=$\frac{6a+5c+d-12b}{4}$kJ/mol,
故答案为:$\frac{6a+5c+d-12b}{4}$.
点评 本题考查较为综合,题目难度中等,本题注意热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握,另外注意反应热的计算,特别是注意分析白磷的氧化磷的分子结构,正确判断共价键的类型和数目.

练习册系列答案
相关题目
15.下列有机物分子中,存在顺反异构的是( )
| A. | 1,2二氯丙烯 | B. | 2丁炔 | C. | 丙烯 | D. | 1丁烯 |
16. 有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
 有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
13.下列说法不正确的是( )
| A. | 电解池的反应属于自发过程 | |
| B. | 化学反应热效应数值与参加反应的物质多少有关 | |
| C. | 化学反应过程中的能量变化除了热能外,也可以是光能、电能等 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
20.已知:①H2O(g)=H2O(l)△H1=-a kJ•mol-1
②C2H5OH(g)=C2H5OH(l)△H2=-b kJ•mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-c kJ•mol-1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
②C2H5OH(g)=C2H5OH(l)△H2=-b kJ•mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-c kJ•mol-1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | (b-a-c)kJ | B. | (3a-b+c )kJ | C. | (a-3b+c)kJ | D. | (b-3a-c)kJ |
10.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2CO3>H2SiO3 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:K2CO3>KHCO3 |
17.下列实验装置正确且能完成实验目的是( )
| A. | 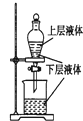 提取海带中的碘 | B. | 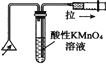 检验火柴燃烧产生的SO2 | ||
| C. | 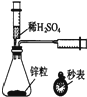 测定一定时间内生成H2的反应速率 | D. | 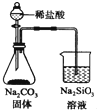 证明非金属性Cl>C>Si |
14.已知aRO4x-+bH++cCl-═dR2++5Cl2↑+8H2O,则RO4x-中R的化合价为( )
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0);平衡时,X、Y、Z的浓度分别为0.2mol•L-1,0.6mol•L-1,0.16mol•L-1,则下列判断不合理的是( )
| A. | 若反应从正方向开始,X、Y的转化率可能不相等 | |
| B. | C1:C2=1:3 | |
| C. | 平衡时,X和Z的生成速率之比为1:2 | |
| D. | C2的取值范围为0<C2<0.84 mol•L-1 |