题目内容
19.下列有关反应热的说法正确的是( )| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
分析 A.弱酸与弱碱在溶液中主要以分子形式存在,电离吸热;
B.等质量的同种物质,气态时具有的能量高;
C.反应热与反应条件无关;
D.燃烧热是指1mol物质完全燃烧生成最稳定的氧化物所放出的热量.
解答 解:A、弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1mol液态水放出的热量小于57.3kJ,故A错误;
B.等质量的同种物质,气态时具有的能量高,所以硫蒸汽的能量大于硫固体的能量,因此,等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故B正确;
C.反应热与反应条件无关,只与反应物的始态和终态有关,所以光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将不变,故C错误;
D.燃烧热是指1mol物质完全燃烧生成最稳定的氧化物所放出的热量,热化学方程式中CO的计量数应该为1,故D错误.
故选B.
点评 本题考查学生燃烧热的概念以及盖斯定律的应用,注意知识的积累和应用是关键,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
14.关于SO2的说法有:
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用.
其中正确的是( )
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用.
其中正确的是( )
| A. | ①②⑤ | B. | ①③④⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
15.某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件.某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.
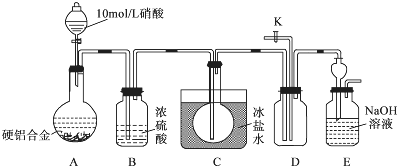
①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
pH>7.8时,Al(OH)3开始溶解,pH>10.8时沉淀完全溶解.
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.

①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
14.氯气溶于水达到平衡后,若只改变某一条件,下列叙述正确的是( )
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
11.实验室制备下列气体时,所用方法正确的是( )
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.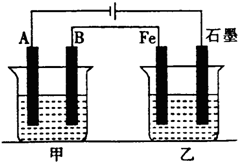 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答: