题目内容
8.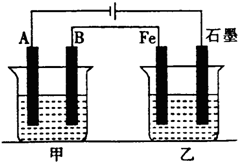 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:(1)A是铁(填电极材料),电极反应式是Ag++e-=Ag;
(2)B是银(填电极材料),甲池应选用的电解质溶液是AgNO3溶液,电解前后该溶液的pH不变(填“变大”、“变小”或“不变”);
(3)乙池阳极电极反应式为:4OH--4e-=O2↑+2H2O,乙池放出的气体在标况下的体积是2.24L;
(4)写出乙溶液中的电解反应的化学方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,电解前后该溶液的pH减小(填“变大”、“变小”或“不变”);需加入16gCuO物质可使该电解质溶液复原.
分析 (1)在铁片上镀银时,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag;
(2)镀层金属银为电解池的阳极,阳极上的电极反应式为Ag-e-=Ag+,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液;
(3)乙中阳极上氢氧根离子失电子生成氧气;结合转移电子守恒计算;
(4)乙中阳极上氢氧根离子失电子生成氧气,阴极上铜离子得电子生成Cu;根据溶液中元素变化判断所需要加入的物质,根据转移电子守恒计算.
解答 解:(1)在铁片上镀银时,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag,则图中A为阴极,即A为铁;
故答案为:铁;Ag++e-=Ag;
(2)镀层金属银为电解池的阳极,B为阳极,则B是银,阳极上的电极反应式为Ag-e-=Ag+,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液,电镀时溶液中离子浓度不变,所以pH不变;
故答案为:银;AgNO3溶液;不变;
(3)乙中阳极上氢氧根离子失电子生成氧气,其电极方程式为:4OH--4e-=O2↑+2H2O;甲池阴极增重43.2g,即析出的银为43.2g,其物质的量为$\frac{43.2g}{108g/mol}$=0.4mol,则转移电子为0.4mol,所以乙中生成的氧气为$\frac{1}{4}$×0.4mol=0.1mol,其体积为2.24L;
故答案为:4OH--4e-=O2↑+2H2O;2.24;
(4)乙中阳极上氢氧根离子失电子生成氧气,阴极上铜离子得电子生成Cu,则电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;反应生成硫酸,溶液的pH减小;电解生成生成Cu和氧气,则溶液中减少的是O元素和铜元素,所以需要加入CuO才能恢复原来的浓度,已知电解时转移电子为0.4mol,则生成的Cu为0.2mol,所以要加入0.2molCuO,其质量为16g;
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;减小;16gCuO.
点评 本题为电化学知识的综合应用,题目难度中等,注意隔绝各电极上得失电子的数目相等来计算.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序,侧重于考查学生的分析能力和计算能力.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 标准状况下,11.2 L CCl4所含的分子数为0.5 NA | |
| B. | 常温常压下,4.2 g C2H4和C8H16的混合物中含有的碳原子数为0.3 NA | |
| C. | 7.8 g苯分子中碳碳双键的数目为0.3 NA | |
| D. | 6.4 g Cu与20 mL 10 mol•L-1浓硫酸反应,转移的电子数为0.2 NA |
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |

| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
| 括号内为杂项 | 除杂试剂 | 除杂操作 | |
| A | Na2O2(Na2O) | O2 | 在纯氧中加热 |
| B | Na2CO3(NaHCO3) | CO2 | 通入过量的CO2 |
| C | FeCl(FeCl2) | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4) | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
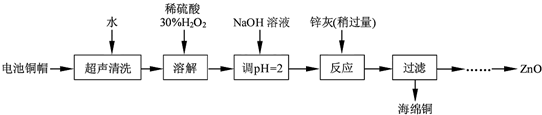
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.