题目内容
9.某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:一是发生氧化还原反应2Fe3++SO32-+H2O═2Fe2++SO42-+2H+,二是发生彻底互促水解反应2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mL FeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色.这种红褐色液体是Fe(OH)3胶体.向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色.将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是Ba2++SO42-=BaSO4↓.
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同.
同学们由上述实验得出的结论是Fe3+和SO32-在溶液中既发生氧化还原反应,又发生互促水解反应.
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为Na2SO3溶液;检验的目的是判断反应前Na2SO3溶液是否已经部分被氧化.
分析 两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
实验I:观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色,可知生成氢氧化铁胶体,加盐酸时先聚沉后溶解;
将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀为硫酸钡;
实验Ⅱ:现象相同,可知都生成胶体,都有硫酸钡生成;
综上所述,氧化还原反应与相互促进水解反应均发生,药品中亚硫酸钠可能变质混有硫酸钠,以此来解答.
解答 解:两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
实验I:观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色,可知生成氢氧化铁胶体,加盐酸时先聚沉后溶解,这种红褐色液体是Fe(OH)3胶体;
将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀为硫酸钡,发生的离子反应为;
实验Ⅱ:现象相同,可知都生成胶体,都有硫酸钡生成;
综上所述,Fe3+和SO32-在溶液中既发生氧化还原反应,又发生互促水解反应;
该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为Na2SO3溶液;检验的目的是,
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑;③Fe(OH)3胶体;Ba2++SO42-=BaSO4↓;Fe3+和SO32-在溶液中既发生氧化还原反应,又发生互促水解反应;Na2SO3溶液;判断反应前Na2SO3溶液是否已经部分被氧化.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、发生的反应为解答该题的关键,侧重分析和实验能力的考查,注意氧化还原反应及水解原理的应用,题目难度不大.

| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
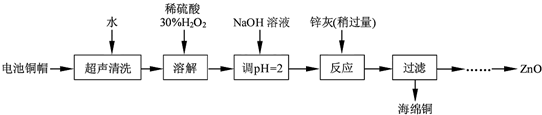
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |