题目内容
锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分.其中生产碳酸锰的工艺流程如下:

请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是 .
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部分被碳还原,MnO2被还原为一氧化锰.已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g);△H=-174.6kJmol-1
C(s)+CO2(g)═2CO(g);△H=+283kJmol-1
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式: .
(3)50-55℃时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
2NH4HCO3═(NH4)2SO4+□ +□ +□ .
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe:7.6-9.6.步骤②中除去的方法是先在酸性条件下加入 ,将Fe2+氧化为Fe3+,然后再将pH调至 ,使Fe3+沉淀完全.
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式: .

请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部分被碳还原,MnO2被还原为一氧化锰.已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g);△H=-174.6kJmol-1
C(s)+CO2(g)═2CO(g);△H=+283kJmol-1
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:
(3)50-55℃时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
2NH4HCO3═(NH4)2SO4+□
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe:7.6-9.6.步骤②中除去的方法是先在酸性条件下加入
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)电池外壳锌皮与硫酸反应可以生成氢气;
(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;
(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,根据形成沉淀的pH范围分析;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子.
(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;
(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,根据形成沉淀的pH范围分析;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子.
解答:
解:(1)锌锰废电池的负极为锌,即电池外壳锌皮,锌与硫酸反应可以生成氢气,则流程中氢气的来源为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物;
故答案为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物;
(2)已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g);△H=-174.6kJmol-1 ①,
C(s)+CO2(g)═2CO(g);△H=+283kJmol-1 ②
由盖斯定律:(①+②)×
得 MnO2(s)+C(s)=MnO(s)+CO(g)△H=(-174.6+283)×
=+54.2kJ?mol-1;
故答案为:MnO2(s)+C(s)=MnO(s)+CO(g)△H=+54.2kJ?mol-1;
(3)该流程的目的是制取碳酸锰,向MnSO4的母液中加入足量NH4HCO3,反应生成碳酸锰之外,还会生成二氧化碳和水,
其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:MnCO3↓、H2O、CO2↑;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,可以用H2O2,其还原产物为水不会引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,已知离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,则调节pH为3.7~8.6之间,使Fe3+完全沉淀,而Mn2+不沉淀;
故答案为:H2O2;3.7~8.6;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子,其电极方程式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
故答案为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物;
(2)已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g);△H=-174.6kJmol-1 ①,
C(s)+CO2(g)═2CO(g);△H=+283kJmol-1 ②
由盖斯定律:(①+②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:MnO2(s)+C(s)=MnO(s)+CO(g)△H=+54.2kJ?mol-1;
(3)该流程的目的是制取碳酸锰,向MnSO4的母液中加入足量NH4HCO3,反应生成碳酸锰之外,还会生成二氧化碳和水,
其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:MnCO3↓、H2O、CO2↑;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,可以用H2O2,其还原产物为水不会引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,已知离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,则调节pH为3.7~8.6之间,使Fe3+完全沉淀,而Mn2+不沉淀;
故答案为:H2O2;3.7~8.6;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子,其电极方程式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评:本题考查了物质制备方案设计,题目涉及盖斯定律的应用、离子方程式的书写、电极反应式的书写、氧化剂的选择等知识,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
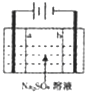 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
从海带灰中可以提取碘,主要反应为:Cl2+2I-═I2+2Cl-,下列说法不正确的是( )
| A、该反应属于置换反应 |
| B、反应中I-离子发生还原反应 |
| C、Cl2的氧化性比I2的氧化性强 |
| D、生成1mol I2转移2mol e- |
与CO分子含有相同电子数的分子是( )
| A、HCl |
| B、N2 |
| C、H2O |
| D、CO2 |
下列操作会引起实验误差的是( )
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度盐酸所用的0.05mol/L NaOH溶液,在配制标准液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往洗净的滴定管中,直接加入标准液 |

 +HX
+HX