题目内容
锰及其化合物在现代工业及国防建设中具有十分重要的地位.
(1)隐形涂料是我国于2014年3月1日成功首飞的最新2011号歼20实现隐形的关键材料.锰锌铁氧体是当前广泛使用的一种隐形材料,其化学组成为MnxZn1-xFe2O4(铁为+3价),当锰、锌、铁三种金属的质量分数分别为4.6%、21.76%、46.86%时,所得到的锰锌铁氧体对雷达波的吸收能力最强,则锰锌铁氧体中锰元素的化合价为 ,当雷达波吸收能力最强时x= .
(2)碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰的一种工艺流程如图所示
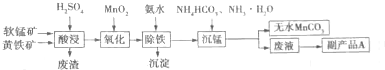
①写出提高酸浸时原料的浸出率的两种方法 ,副产品A是 ,从废墟中提取A的方法是 .
②酸浸时的氧化物是Fe3+、SO42-,写出对应的离子方程式: ,写出沉锰时反应的离子方程式:
(3)KMnO4是一种十分重要的氧化剂,工业可以软锰矿为原料先制得锰酸钾,然后电解锰酸钾溶液就可以得到KMnO4,则电解时阳极上的电极反应式为 ,当电路中有2 mol电子通过时,阳极上得到的产物的质量为 .
(1)隐形涂料是我国于2014年3月1日成功首飞的最新2011号歼20实现隐形的关键材料.锰锌铁氧体是当前广泛使用的一种隐形材料,其化学组成为MnxZn1-xFe2O4(铁为+3价),当锰、锌、铁三种金属的质量分数分别为4.6%、21.76%、46.86%时,所得到的锰锌铁氧体对雷达波的吸收能力最强,则锰锌铁氧体中锰元素的化合价为
(2)碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰的一种工艺流程如图所示

①写出提高酸浸时原料的浸出率的两种方法
②酸浸时的氧化物是Fe3+、SO42-,写出对应的离子方程式:
(3)KMnO4是一种十分重要的氧化剂,工业可以软锰矿为原料先制得锰酸钾,然后电解锰酸钾溶液就可以得到KMnO4,则电解时阳极上的电极反应式为
考点:制备实验方案的设计
专题:
分析:(1)根据物质的量之比等于原子个数之比,得
:
=x:2,x=0.2;Zn的化合价为+2,根据物质的化合价为零求Mn的化合价;
(2)①升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度;溶浸过程中发生的反应生成硫酸根离子,后来又加入了氨水、碳酸氢铵,所以副产品是(NH4)2SO4,可以用重结晶法提取(NH4)2SO4;
②FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,对应的离子方程式为2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;加入碳酸氢氨生成碳酸锰沉淀,离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~KMnO4求质量.
| 4.6% |
| 55 |
| 46.86% |
| 56 |
(2)①升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度;溶浸过程中发生的反应生成硫酸根离子,后来又加入了氨水、碳酸氢铵,所以副产品是(NH4)2SO4,可以用重结晶法提取(NH4)2SO4;
②FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,对应的离子方程式为2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;加入碳酸氢氨生成碳酸锰沉淀,离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~KMnO4求质量.
解答:
解:(1)根据物质的量之比等于原子个数之比,得
:
=x:2,x=0.2;Zn的化合价为+2,根据物质的化合价为零,设Mn的化合价为y,则0.2y+2×0.8+2×3=4×2,y=+2;故答案为:+2;0.2;
(2)①升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度;溶浸过程中发生的反应生成硫酸根离子,后来又加入了氨水、碳酸氢铵,所以副产品是(NH4)2SO4,可以用重结晶法提取(NH4)2SO4;
故答案为:研磨矿石,适当提高稀硫酸的浓度等;(NH4)2SO4;重结晶法;
②FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,对应的离子方程式为2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;加入碳酸氢氨生成碳酸锰沉淀,离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
故答案为:2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~KMnO4,当电路中有2 mol电子通过时,阳极上得到1molKMnO4,m(KMnO4)=1mol×158g/mol=158g;
故答案为:2MnO42--2e-=2MnO4-;158g.
| 4.6% |
| 55 |
| 46.86% |
| 56 |
(2)①升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度;溶浸过程中发生的反应生成硫酸根离子,后来又加入了氨水、碳酸氢铵,所以副产品是(NH4)2SO4,可以用重结晶法提取(NH4)2SO4;
故答案为:研磨矿石,适当提高稀硫酸的浓度等;(NH4)2SO4;重结晶法;
②FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,对应的离子方程式为2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;加入碳酸氢氨生成碳酸锰沉淀,离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
故答案为:2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-;Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~KMnO4,当电路中有2 mol电子通过时,阳极上得到1molKMnO4,m(KMnO4)=1mol×158g/mol=158g;
故答案为:2MnO42--2e-=2MnO4-;158g.
点评:本题以工业流程图为依托,考查了化学式的计算、离子方程式的书写、电极反应式等,题目难度较大,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
下列物质中,含有的分子数目最少的是( )
| A、0.5molCO2 |
| B、标准状况下11.2L氨气 |
| C、8 g水 |
| D、6.02×1023个氯分子 |
将a克Fe2O3 、Al2O3 样品溶解在过量的200mL c(H+)=0.1mol?L-1 的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+ 刚好完全沉淀,用去NaOH溶液100mL,则NaOH 溶液的浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中不正确的是( )
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
已知2Na2O2+2CO2=2Na2CO3+O2,关于上述反应的有关说法正确的是( )
| A、CO2在反应中是还原剂 |
| B、每摩尔Na2O2完全反应时转移电子1mol |
| C、反应中O2既是氧化产物,又是还原产物 |
| D、上述反应可用于潜水艇中提供氧气 |





 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为