题目内容
17.一定条件下,向一带活塞的密闭容器中充人 2mol SO2 和 1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )| A. | 保持温度和容器体积不变,充入 1 mol SO3(g) | |
| B. | 保持温度和容器内压强不变,充入 1 mol SO3(g) | |
| C. | 保持温度和容器内压强不变,充入 1 mol O2(g) | |
| D. | 保持温度和容器内压强不变,充入 l mol Ar(g) |
分析 达到平衡后,改变条件,SO3的平衡浓度不改变的,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析.
解答 解:A、温度和容器的体积不变,充入1mol SO2(g),增大反应物的浓度平衡正移,SO3气体平衡浓度增大,故A错误;
B、温度和容器的压强不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,满足n(SO2):n(O2)=2:1,与原来的平衡是等效平衡,所以SO3气体平衡浓度不改变,故B正确;
C、保持温度和容器的压强不变,充入1mol O2(g),增大反应物的浓度平衡正移,平衡向正反应移动,SO3的平衡浓度增大,故C错误;
D、保持温度和容器的压强不变,充入1mol Ar,体积增大,反应混合物产生的压强减小,平衡向逆反应移动,移动的结果是减小SO3的浓度,所以SO3的平衡浓度减小,故D错误;
故选B.
点评 本题考查等效平衡原理的应用,学生要清楚一带活塞的密闭容器相当于压强不变,难度中等,特殊D选项充入稀有气体导致体积变大,相当于减小压强.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.煤的气化过程中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),若在恒温压容器中充入1mol CO和3mol 水蒸气发生上述反应,达到平衡时测得反应物
与生成物的物质的量之比为5:3,且吸收热量180kJ,请回答下列问题:
(1)该反应的热化学方程式可写为CO(g)+H2O=CO2(g)+H2(g)△=+240kJ/mol.
(2)两种反应物的转化率之和为1.
(3)该条件下此反应的平衡常数为1.
(4)若要在相同的温度下和相同的容器中,按下列物料配比充入,建立平衡后CO的体积百分含量与题干平衡相同,下列选项中可行的是ABC.
(5)若要在相同的温度下和相同的容器中,充入下列物料建立平衡,平衡后CO2的体积分数与题干平衡的CO2的体积分数相同,但CO的体积分数与题干平衡中CO的体积分数不同的是BC.
与生成物的物质的量之比为5:3,且吸收热量180kJ,请回答下列问题:
(1)该反应的热化学方程式可写为CO(g)+H2O=CO2(g)+H2(g)△=+240kJ/mol.
(2)两种反应物的转化率之和为1.
(3)该条件下此反应的平衡常数为1.
(4)若要在相同的温度下和相同的容器中,按下列物料配比充入,建立平衡后CO的体积百分含量与题干平衡相同,下列选项中可行的是ABC.
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 4mol | 2mol | 2mol |
| B | 0.5mol | 2.5mol | 0.5mol | 0.5mol |
| C | 1mol | 4mol | 0.5mol | 0.5mol |
| D | 0mol | 0mol | 1mol | 3mol |
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 0mol | 1mol | 3mol |
| B | 2.5mol | 0.5mol | 0.5mol | 0.5mol |
| C | 3mol | 1mol | 0mol | 0mol |
| D | 0mol | 0mol | 3mol | 1mol |
6.乙酸橙花酯是一种食用香料,其结构简式如图,它含有的官能团有( )


| A. | 1种 | B. | 3种 | C. | 4种 | D. | 2种 |
7.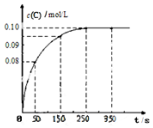 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
 丁达尔效应的是
丁达尔效应的是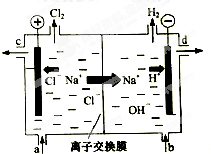 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.