题目内容
10.如图只表示出与反应有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请写出下列空白.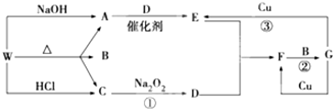
(1)化合物W的化学式可能是(NH4)2CO3或NH4HCO3,C的电子式
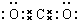 ,F的颜色红棕色.
,F的颜色红棕色.(2)反应③的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O.
(3)反应②中氧化剂和还原剂的物质的量之比为1:2.
(4)写出A→E的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 W能和NaOH、HCl反应生成无色气体,A和D反应生成E,C能和过氧化钠反应生成D,且W能分解生成两种气体;D能和E反应生成F,F和B反应生成G,E、F中含有相同元素,G能和Cu反应生成两种物质,则G为HNO3,E为NO、D为O2、F为NO2,W应该为铵盐,A为NH3、C为CO2,则B为H2O,W为(NH4)2CO3或NH4HCO3,结合题目分析解答.
解答 解:W能和NaOH、HCl反应生成无色气体,A和D反应生成E,C能和过氧化钠反应生成D,且W能分解生成两种气体,
D能和E反应生成F,F和B反应生成G,E、F中含有相同元素,G能和Cu反应生成两种物质,则G为HNO3,E为NO、D为O2、F为NO2,W应该为铵盐,A为NH3、C为CO2,则B为H2O,W为(NH4)2CO3或NH4HCO3,
(1)通过以上分析知,W为(NH4)2CO3或NH4HCO3,C是二氧化碳,二氧化碳为共价化合物,分子中含有两个碳氧双键,其电子式为;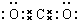 ;F为二氧化氮,二氧化氮为红棕色气体,
;F为二氧化氮,二氧化氮为红棕色气体,
故答案为:(NH4)2CO3;NH4HCO3;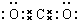 ;红棕色;
;红棕色;
(2)反应③为Cu和稀硝酸反应生成NO,反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(3)该反应为3NO2+H2O=2HNO3+NO,该反应中有$\frac{2}{3}$的二氧化氮作还原剂、有$\frac{1}{3}$的二氧化氮作氧化剂,所以发生还原反应和氧化反应的物质的质量之比为1:2,
故答案为:1:2.
(4)A为NH3,E为NO,A→E的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题以N元素为载体考查元素化合物推断,为高频考点,侧重考查学生分析判断及知识综合运用能力,以G与Cu的反应为突破口采用正逆结合的方法进行推断,还涉及离子方程式的书写、氧化还原反应、物质结构等知识点,题目难度不大.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | a+2=b+1=c-3=d-1 | B. | 原子半径:r(A)>r(B)>r(D)>r(C) | ||
| C. | 原子序数:a>b>c>d | D. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) |
| A. | 2mol钠与过量盐酸反应生成NA个H2分子 | |
| B. | 少量金属钠加到冷水中,反应的离子方程式是:Na+2H2O═Na++OH-+H2↑ | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 | |
| D. | 为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量 |
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Fe Cl3溶液中加入足量的氨水:Fe3++3OH-=Fe (OH)3↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ | |
| D. | 用小苏打治疗胃酸过多病:HCO3-+H+=CO2↑+H2O |
| A. | 向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+ | |
| B. | 向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝 | |
| C. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
 为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题:
为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题: 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: