题目内容
15.某物质A在一定条件下加热分解,产物都是气体.分解方程式为2A→3B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )| A. | 5d | B. | 6d | C. | 7d | D. | 8d |
分析 相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2dg/mol,根据质量守恒再结合M=$\frac{m}{n}$计算A的摩尔质量,摩尔质量在数值上等于其相对分子质量.
解答 解:相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2dg/mol,
假设有2molA反应则生成3molB、2molC、2molD,生成物的质量=2dg/mol×(3+2+2)mol=14dg,反应前后质量不变,则A的质量为14dg,其摩尔质量=$\frac{14dg}{2mol}$=7dg/mol,摩尔质量在数值上等于其相对分子质量,所以A的相对分子质量为7d,
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下不同气体密度与其相对分子质量的关系是解本题关键,再结合基本公式分析解答,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
5.下列叙述错误的是( )
| A. | 1mol任何物质都含有6.02×1023个原子 | |
| B. | 0.012kg12C 含有阿伏加德罗常数个碳原子 | |
| C. | 在使用摩尔表示物质的量的单位时,应指明粒子的种类 | |
| D. | 物质的量是国际单位制中七个基本物理量之一 |
6.含下列某种杂质的氯化钠样品,经测定氯的质量分数为62.0%,则该样品中含有的杂质可能是( )
| A. | MgCl2 | B. | ZnCl2 | C. | BaCl2 | D. | KCl |
3.下列与化学概念有关的说法正确的是( )
| A. | 化合反应均为氧化还原反应 | B. | 金属氧化物均为碱性氧化物 | ||
| C. | 烧碱、纯碱、熟石灰都是碱 | D. | BaSO4、NaOH、HNO3都是强电解质 |
7.卤素互化物的化学性质跟卤素单质相似,其氧化性介于形成该互化物两卤素单质之间.溴化碘(IBr)是卤素互化物的一种,这种化合物在常温常压下是深红色的固体,熔点为41℃,沸点为116℃.下列对IBr的叙述中,错误的是( )
| A. | 溴化碘能与金属和非金属反应 | B. | 它可与水反应:IBr+H2O→HBrO+HI | ||
| C. | 它可KI溶液反应 KI+IBr→KBr+I2 | D. | 固体溴化碘是一种分子晶体 |
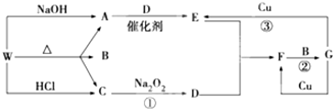
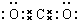 ,F的颜色红棕色.
,F的颜色红棕色.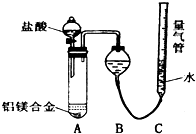 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.