题目内容
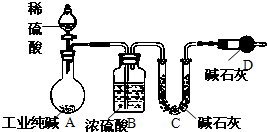 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:(1)装置中盛装稀硫酸的仪器名称是
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为
(3)若不考虑操作、药品及其用量等方面的影响,该实验测得结果会
考点:探究物质的组成或测量物质的含量,实验装置综合
专题:实验设计题
分析:纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,由实验装置可知,A中发生纯碱与硫酸的反应生成二氧化碳,B为干燥气体,C吸收二氧化碳,利用C中的质量查确定二氧化碳的质量,D防止空气中的二氧化碳进入C中,以此来解答.
解答:
解:由实验装置可知,A中发生纯碱与硫酸的反应生成二氧化碳,B为干燥气体,C吸收二氧化碳,利用C中的质量查确定二氧化碳的质量,D防止空气中的二氧化碳进入C中,
(1)盛装稀硫酸的仪器名称是分液漏斗;装置D的作用为防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定,
故答案为:分液漏斗;防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(2)实验中,称量C反应前后的质量,且称量纯碱的质量,则一次实验中至少应进行称量操作的次数为3次,故答案为:3;
(3)不考虑操作、药品及其用量等方面的影响,该实验中反应产生的CO2在装置A、B中有残留 (或CO2未能被装置C中的碱石灰完全吸收 ),则实验测定结果偏低,
故答案为:偏低;反应产生的CO2在装置A、B中有残留 (或CO2未能被装置C中的碱石灰完全吸收 ).
(1)盛装稀硫酸的仪器名称是分液漏斗;装置D的作用为防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定,
故答案为:分液漏斗;防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(2)实验中,称量C反应前后的质量,且称量纯碱的质量,则一次实验中至少应进行称量操作的次数为3次,故答案为:3;
(3)不考虑操作、药品及其用量等方面的影响,该实验中反应产生的CO2在装置A、B中有残留 (或CO2未能被装置C中的碱石灰完全吸收 ),则实验测定结果偏低,
故答案为:偏低;反应产生的CO2在装置A、B中有残留 (或CO2未能被装置C中的碱石灰完全吸收 ).
点评:本题考查物质含量的测定实验,为高频考点,把握实验中装置的作用为解答的关键,侧重分析与实验能力的综合考查,注意误差分析,题目难度不大.

练习册系列答案
相关题目
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素.下列说法不正确的是( )
| A、沸点:X2Y>X2W |
| B、由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键 |
| C、原子半径:X<Y<Z<W<R |
| D、Y与W形成的化合物WY2是形成酸雨的主要物质之一 |
在一种pH=1的溶液中可能存在NO3-,I-,Cl-,Fe3+中的一种或几种.向该溶液中滴入溴水,单质溴被还原.由此推断该溶液( )
| A、含NO3-,Fe3+,无I-,可能有Cl- |
| B、含I-,不含NO3-,Fe3+,可能有Cl- |
| C、含I-,Fe3+,不含NO3-,可能有Cl- |
| D、含NO3-,不含I-,Fe3+,可能有Cl- |
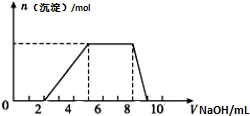 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
 (1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
(1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )