题目内容
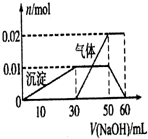
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
考点:有关混合物反应的计算
专题:计算题
分析:设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,
由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,
根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,
沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,
计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,确定溶液中n(Mg2+)和n(Al3+),据此计算n(Cl-)与n(SO42-).
由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,
根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,
沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,
计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,确定溶液中n(Mg2+)和n(Al3+),据此计算n(Cl-)与n(SO42-).
解答:
解:设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,
由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,
根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,
计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,
则n(Mg2+)=0.125Vmol,n(Cl-)=0.25Vmol;n(Al3+)=0.25Vmol,
n(SO42-)=
n(Al3+)=
×0.25Vmol,
溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol:
×0.25Vmol=2:3.
故选D.
由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,
根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,
计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,
则n(Mg2+)=0.125Vmol,n(Cl-)=0.25Vmol;n(Al3+)=0.25Vmol,
n(SO42-)=
| 3 |
| 2 |
| 3 |
| 2 |
溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol:
| 3 |
| 2 |
故选D.
点评:本题考查镁铝化合物性质、混合物的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,清楚图象反应过程是解题关键.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
下列说法正确的是( )
A、已知 ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y |
B、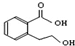 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 |
| C、3-甲基-3-乙基戊烷的一氯取代产物为5种 |
| D、相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
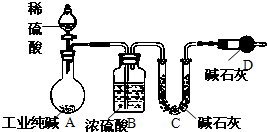 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答: 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题: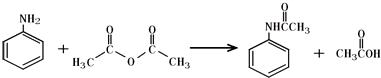
 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种