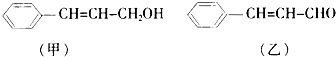题目内容
下列说法正确的是( )
| A、用丙酮与盐酸的混合液作展开剂,对Fe3+与Cu2+用纸层析法分离时,Fe3+移动较快 |
| B、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
| C、用瓷坩锅高温熔融NaOH和Na2CO3的固体混合物 |
| D、标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
考点:有机化学反应的综合应用,钠的重要化合物,中和滴定
专题:
分析:A.常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大;
B.将粗产品加入饱和NaOH溶液中,阿司匹林可与NaOH反应而变质;
C.二氧化硅能够与氢氧化钠和碳酸钠反应;
D.根据未经标准溶液润洗的滴定管中溶液的物质的量浓度是否变化判断.
B.将粗产品加入饱和NaOH溶液中,阿司匹林可与NaOH反应而变质;
C.二氧化硅能够与氢氧化钠和碳酸钠反应;
D.根据未经标准溶液润洗的滴定管中溶液的物质的量浓度是否变化判断.
解答:
解:A.在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,Fe3+移动较快,故A正确;
B.阿司匹林含有羧基和酯基,都可在碱性条件下反应,将粗产品加入饱和NaOH溶液中,阿司匹林可与NaOH反应而变质,故B错误;
C.陶瓷中含有二氧化硅,二氧化硅能够与碳酸钠、氢氧化钠高温下反应,所以不能用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物,故C错误;
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,导致盐酸的浓度偏小,滴定碱时,使用的酸体积偏大,则测定结果偏高,故D错误;故选A.
B.阿司匹林含有羧基和酯基,都可在碱性条件下反应,将粗产品加入饱和NaOH溶液中,阿司匹林可与NaOH反应而变质,故B错误;
C.陶瓷中含有二氧化硅,二氧化硅能够与碳酸钠、氢氧化钠高温下反应,所以不能用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物,故C错误;
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,导致盐酸的浓度偏小,滴定碱时,使用的酸体积偏大,则测定结果偏高,故D错误;故选A.
点评:本题主要考查的是二氧化硅的性质、酸碱中和滴定等,难度一般,注意总结.

练习册系列答案
相关题目
下列有关实验的叙述正确的是( )
| A、蒸发皿可用来研磨块状固体物质 |
| B、锥形瓶作为反应容器时一定不能加热 |
| C、分液漏斗不宜盛装碱性溶液 |
| D、可用湿润的蓝色石蕊试纸检测氨气 |
下列有关实验原理或操作正确的是( )
A、 分离沸点相差较大的互溶液体混合物 |
B、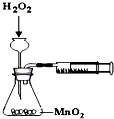 测定化学反应速率 |
C、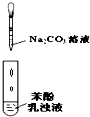 比较苯酚、碳酸的酸性强弱 |
D、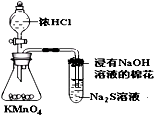 比较KMnO4、Cl2、S的氧化性 |
下列各组离子在指定溶液中能大量共存的是( )
| A、能使甲基橙变红的溶液中:Na+、K+、AlO2-、SO42- | ||
B、
| ||
| C、加入Al能放出H2 的溶液中:Br-、HSO3 -、SO42-、Fe2+ | ||
| D、由水电离出的c(OH-)=10-11mol?L-1 的溶液中:Na+、K+、Cl-、NO3- |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O
KIO3+3H2↑.下列有关说法不正确的是( )
| ||
| A、电解时,石墨作阳极,不锈钢作阴极 |
| B、电解时的阳极电极反应式:I--6e-+3H2O=IO3-+6H+ |
| C、当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D、电解一段时间后,电解质溶液的pH变小 |
葡萄糖燃烧的热化学反应方程式:C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)+2870kJ,此反应说明( )
| A、自然界中的一切物质的能量均来自太阳 |
| B、人体每摄入1摩尔葡萄糖,就为人体提供2870kJ能量 |
| C、人体所需的能量均来自于葡萄糖的氧化 |
| D、1摩尔固态葡萄糖和6摩尔氧气所含能量大于6摩尔CO2和6摩尔液态水所含的总能量 |