题目内容
下列有关实验原理或操作正确的是( )
A、 分离沸点相差较大的互溶液体混合物 |
B、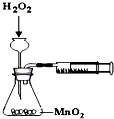 测定化学反应速率 |
C、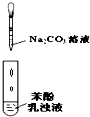 比较苯酚、碳酸的酸性强弱 |
D、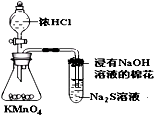 比较KMnO4、Cl2、S的氧化性 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.蒸馏时,温度计测量馏分温度;
B.长颈漏斗的下端没有在液面以下,量筒中收集不到气体;
C.应该用强酸制取弱酸判断酸的强弱;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
B.长颈漏斗的下端没有在液面以下,量筒中收集不到气体;
C.应该用强酸制取弱酸判断酸的强弱;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答:
解:A.蒸馏时,温度计测量馏分温度,温度计水银球位于支管口处,故A错误;
B.长颈漏斗的下端没有在液面以下,量筒中收集不到气体,则不能测定分解速率,故B错误;
C.应该用强酸制取弱酸判断酸的强弱,所以应该将二氧化碳通入苯酚钠溶液中确定酸性强弱,故C错误;
D.高锰酸钾与浓盐酸反应生成氯气,氯气与硫离子反应生成S,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性为KMnO4>Cl2>S,故D正确;
故选D.
B.长颈漏斗的下端没有在液面以下,量筒中收集不到气体,则不能测定分解速率,故B错误;
C.应该用强酸制取弱酸判断酸的强弱,所以应该将二氧化碳通入苯酚钠溶液中确定酸性强弱,故C错误;
D.高锰酸钾与浓盐酸反应生成氯气,氯气与硫离子反应生成S,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性为KMnO4>Cl2>S,故D正确;
故选D.
点评:本题考查化学实验方案评价,为高考高频点,涉及氧化还原反应强弱比较、酸的强弱比较、蒸馏等知识点,侧重考查基本理论、实验操作,易错选项是C.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )
如图是两组物质之间在一定的条件下相互转化的过程.下列绿色植物通过光合作用说法不正确的是( )| A、物质X是O2 |
| B、绿色植物通过光合作用,将太阳能转化成化学能 |
| C、C6H12O6是碳氢氧三种元素组成的化合物 |
| D、C6H12O6与X反应生成CO2和H2O属于置换反应 |
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是( )
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、氯气本身有毒,可以直接杀死水中的细菌和病毒,所以液氯可用于自来水的消毒剂 |
| D、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O |
下列说法正确的是( )
| A、用丙酮与盐酸的混合液作展开剂,对Fe3+与Cu2+用纸层析法分离时,Fe3+移动较快 |
| B、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
| C、用瓷坩锅高温熔融NaOH和Na2CO3的固体混合物 |
| D、标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
下列说法不正确的是( )
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|
Na2O2、CaC2都是离子化合物,都能与水反应放出气体.它们 ( )
| A、阴阳离子个数比均为1:1 |
| B、都含有非极性的共价键 |
| C、与水都发生氧化还原反应 |
| D、放出的都是可燃性气体 |

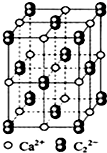 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2