题目内容
硫单质及其化合物在工农业生产中有着重要的应用.
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
Sx(s)△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+
Sx(s)△H=bkJ/mol.
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是: .
(2)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如图1所示:
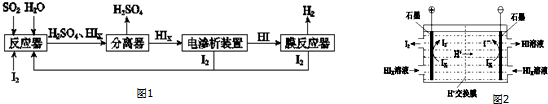
①写出反应器中发生反应的化学方程式是: .
②电渗析装置如图2所示,
写出阳极的电极反应式: .该装置中发生的总反应的化学方程式: .
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是:
(2)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如图1所示:

①写出反应器中发生反应的化学方程式是:
②电渗析装置如图2所示,
写出阳极的电极反应式:
考点:热化学方程式,电解原理
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI.
(2)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI.
解答:
解:(1)①SO2(g)+2CO(g)═2C02(g)+
Sx(s)△H=a kJ?mol-1;
②2COS(g)+SO2(g)═2CO2(g)+
Sx(s)△H=b kJ?mol-1.
依据盖斯定律(②-①×2)÷2得到:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol,
故答案为:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
(2)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+x I2+2H2O═H2SO4+2HIX,故答案为:SO2+x I2+2H2O═H2SO4+2HIX;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI,故答案为:2Ix--2e-=xI2;2HIx=(x-1)I2+2HI.
| 1 |
| x |
②2COS(g)+SO2(g)═2CO2(g)+
| 3 |
| x |
依据盖斯定律(②-①×2)÷2得到:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol,
故答案为:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;
(2)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+x I2+2H2O═H2SO4+2HIX,故答案为:SO2+x I2+2H2O═H2SO4+2HIX;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI,故答案为:2Ix--2e-=xI2;2HIx=(x-1)I2+2HI.
点评:本题考查盖斯定律计算、离子浓度大小比较、电解原理等,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意利用守恒思想比较溶液中微粒浓度大小.

练习册系列答案
相关题目
下列说法正确的是( )
| A、用丙酮与盐酸的混合液作展开剂,对Fe3+与Cu2+用纸层析法分离时,Fe3+移动较快 |
| B、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
| C、用瓷坩锅高温熔融NaOH和Na2CO3的固体混合物 |
| D、标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
下列说法不正确的是( )
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
每年5月31日为世界无烟日.吸烟有害健康,下列属于烟气中的一种有毒气体是( )
| A、O2 |
| B、N2 |
| C、CO |
| D、CO2 |
Na2O2、CaC2都是离子化合物,都能与水反应放出气体.它们 ( )
| A、阴阳离子个数比均为1:1 |
| B、都含有非极性的共价键 |
| C、与水都发生氧化还原反应 |
| D、放出的都是可燃性气体 |
下列物质放在空气中,不会发生变质的物质是( )
| A、Na |
| B、NaCl |
| C、NaOH |
| D、Na2O2 |
 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2