题目内容
11.几种晶体的晶胞如图所示: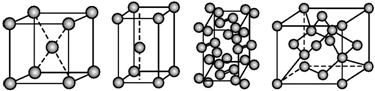
所示晶胞从左到右分别表示的物质正确的排序是( )
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
分析 钠属于金属晶体,为体心立方结构,钠原子在晶胞的对角线处相互接触;锌为金属晶体,为密排六方晶格,面心立方晶胞;碘为分子晶体,每个碘分子有两个碘原子,作用力为分子间作用力;金刚石为原子晶体,晶胞中有8个C原子处在立方体的顶点、6个处于面心,此外晶胞内部还出现了4个C原子(把晶胞分成8个小立方体的话,这些C处于其中交错的4个的体心).
解答 解:钠属于金属晶体,为体心立方结构,钠原子在晶胞的对角线处相互接触;锌为金属晶体,为密排六方晶格,面心立方晶胞;碘为分子晶体,每个碘分子有两个碘原子,作用力为分子间作用力;金刚石晶胞中有8个C原子处在立方体的顶点、6个处于面心,此外晶胞内部还出现了4个C原子(把晶胞分成8个小立方体的话,这些C处于其中交错的4个的体心),经上分子,第一个图为钠晶体的晶胞结构,第二图为锌晶体的晶胞结构,第三个图为碘晶体的晶胞结构,第四个图为金刚石的晶胞图,故选C.
点评 本题考查了不同晶体的晶胞结构图,要求记住常见晶体的晶胞结构,难度中等,但也是易错点.

练习册系列答案
相关题目
1.已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
| A. | 在饱和AgCl、AgBr的混合溶液中c(Cl-)/c(Br-)=360 | |
| B. | 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 向含有AgCl的饱和溶液中加入少量水后,c(Cl-)不变 |
2.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④结合质子能力:OH->CH3COO->Cl-.
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
19.放射性同位素${\;}_{92}^{238}$U的原子核内的中子数和核外电子数之差是( )
| A. | 54 | B. | 92 | C. | 146 | D. | 238 |
6.下列关于充电电池的叙述,不正确的是( )
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
16.NA为阿伏加罗常数,下列有关说法正确的是( )
| A. | 16.5克过氧化钾晶体中,含0.3NA个阴离子 | |
| B. | 1mol铜粉与硫粉充分反应可转移2mol电子 | |
| C. | 含等物质的量溶质的NaHSO4溶液和Na2SO4 溶液中,均含2NA个阳离子 | |
| D. | 20 g NH3T+中含有中子数为9NA |
3.甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知:A+B=D+F,A+C=E+F;D是强碱,下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
20.下列鉴别方法不可行的是( )
| A. | 用KMnO4(H+)溶液鉴别甲苯、丙烯、已烷 | |
| B. | 用溴水鉴别苯、丙烯、四氯化碳 | |
| C. | 用水鉴别乙醇、苯、四氯化碳 | |
| D. | 用NaOH溶液鉴别溴乙烷、甲苯、硝基苯 |