题目内容
1.甲乙两位同学分别用不同的方法配制85mL 3.6mol/L.的稀硫酸.(1)若采用98%的浓硫酸(密度为1.80g/ml),的浓硫酸配制溶液,需要用到浓硫酸的体积为20.0mL.
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100mL,容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀.
①将溶液转移到容量瓶中的正确操作是将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中.若定容时仰视刻度线,则所配溶液浓度偏小(填“偏大”、“偏小”或“无影响”)
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是使溶质完全转移到容量瓶中.
③定容的正确操作是加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;.
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是D(填序号).
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
(3)乙学生:用100mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100mL刻度线,再搅拌均匀.你认为此法是否正确?若不正确,指出其中错误之处不能用量筒配制溶液、不能将水加入到浓硫酸中.
分析 (1)浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)①容量瓶瓶颈较细,移液时需要用玻璃棒引流;定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析;
②从洗涤液不倒入容量瓶能否产生误差进行分析;
③依据定容的正确操作解答;
④错误操作导致实验失败且无法挽回的必须重新配制;
(3)根据量筒的作用、将水加入硫酸中有何危险分析.
解答 解:(1)98%的浓硫酸(密度为1.80g/ml)硫酸的物质的量浓度C=$\frac{1000×1.80×98%}{98}$=18mol/L,配制制85mL 3.6mol/L,应选择100mL容量瓶,依据溶液稀释过程中溶质的物质的量不变得:V×18mol/L=100mL×3.6mol/L,解得V=20.0mL;
故答案为:20.0mL;
(2)①若将玻璃棒插入容量瓶刻度线以上,会使少量溶液滞留在刻度线以上而导致定容时有偏差;由于容量瓶劲较细,为避免溶液洒在外面应用玻璃棒引流;
定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$,溶液浓度偏小;
故答案为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;偏小;
②洗涤液中含有部分溶质,不将洗涤液倒入容量瓶中,会导致溶液浓度降低,
故答案为:使溶质完全转移到容量瓶中;
③加水至离刻度线1~2cm时,用胶头滴管滴加水,容易控制水的体积,液面是凹形的,只有液面最低端与刻度线相切时,才是溶液的真实体积,否则,会造成浓度有偏差,
故答案为:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,无论采取A、B、C的何种方式都不能配置成需要的溶液,只能重新配制;
故答案为:D;
(3)量筒只能量取液体不能配置溶液,如果将水加入浓硫酸中会造成液体飞溅,
故答案为:不能用量筒配制溶液、不能将水加入到浓硫酸中.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理及正确的操作步骤是解题关键,注意容量瓶使用方法和注意事项,注意浓硫酸的稀释操作,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
所示晶胞从左到右分别表示的物质正确的排序是( )
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
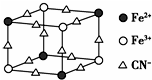
| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
| A. | MClx | B. | MCl2y/x | C. | MxCly | D. | MyClx |
| A. | 还原性:Z->Y2- | B. | 原子半径:W>X>Y>Z | ||
| C. | 离子半径:Y2->Z->X+>W3+ | D. | 原子序数d>c>b>a |
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | Y与Q的氢化物相遇生成白烟 | |
| C. | 气态氢化物的还原性:W>X>Y | |
| D. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
| A. | H2O | B. | H2SO4 | C. | KOH | D. | KNO3 |
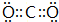 ,B与D形成的原子个数比为1:1的化合物乙的电子式是
,B与D形成的原子个数比为1:1的化合物乙的电子式是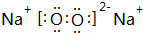 .
.