题目内容
2.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②根据同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大判断;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④根据H2O、CH3COOH、HCl的电离程度越大,其离子结合质子能力越弱来分析.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故①错误;
②同周期元素从左到右原子半径逐渐减小,因此Na>Mg>S,同主族元素从上到下原子半径逐渐增大,所以K>Na,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4,故③错误;
④因H2O、CH3COOH、HCl的电离程度:HCl>CH3COOH>H2O,所以结合质子能力OH->CH3COO->Cl-,故④正确;
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
9.联苯(结构如图所示 ,碳碳单键可以旋转)的二氯代物有( )
,碳碳单键可以旋转)的二氯代物有( )
 ,碳碳单键可以旋转)的二氯代物有( )
,碳碳单键可以旋转)的二氯代物有( )| A. | 9种 | B. | 12种 | C. | 20种 | D. | 24种 |
10.甲酸甲酯和甲酸的混合物中,氧元素的质量分数为65%,则碳元素的质量分数为( )
| A. | 15% | B. | 20% | C. | 25% | D. | 30% |
7.已知反应A2+B2═2AB,破坏1mol A2中的化学键消耗的能量为Q1 kJ,破坏1mol B2中的化学键消耗的能量为Q2 kJ,形成1mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
11.几种晶体的晶胞如图所示:
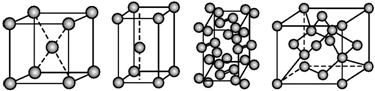
所示晶胞从左到右分别表示的物质正确的排序是( )

所示晶胞从左到右分别表示的物质正确的排序是( )
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
12.如图是蓝色晶体MxFey(CN)6中阴离子的最小结构单元(图中是该晶体晶胞的八分之一)下列说法正确的是( )
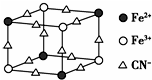

| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
 .
.

 按要求回答下列问题:
按要求回答下列问题: