题目内容
某校化学兴趣小组进行了下列三项实验活动:
(1)探究草酸(H2C2O4)与高锰酸钾溶液在 不同条件下反应的快慢;
(2)测定草酸晶体的纯度;
(3)探究Fe2+和I-还原性的强弱.
已知:①Mn04_在酸性环境下的还原产物是Mn2+;②草酸是二元弱酸.
Ⅰ.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加入相应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所 示(表中“一”表示未加入该试剂).
根据以上4组实验,可以得出的结论主要有
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4?2H2O)Wg;配制成250mL溶液;每次移取25.00 mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2-3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 .
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为 (以含W、V的表达式表示).
Ⅲ.探究Fe2+和I-还原性的强弱
【猜想假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强.
【实验验证】请在下表中写出实验步骤及预期现象和结论.
【思考与拓展】请你设计一个简单方案,证明I-的还原性强于Fe2+ (写出实验步骤及现象):
(1)探究草酸(H2C2O4)与高锰酸钾溶液在 不同条件下反应的快慢;
(2)测定草酸晶体的纯度;
(3)探究Fe2+和I-还原性的强弱.
已知:①Mn04_在酸性环境下的还原产物是Mn2+;②草酸是二元弱酸.
Ⅰ.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加入相应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所 示(表中“一”表示未加入该试剂).
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 | 0.10mol/L KMnO4溶液 |
褪色 时间 |
| 1 | 650C | ---- | --- | 1mL | 1OOs |
| 2 | 650C | 10滴 | --- | 1mL | 90s |
| 3 | 750C | 10滴 | ---- | 1mL | 40s |
| 4 | 750C | 10滴 | 加入少许 | 1mL | 3s |
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4?2H2O)Wg;配制成250mL溶液;每次移取25.00 mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2-3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为
Ⅲ.探究Fe2+和I-还原性的强弱
【猜想假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强.
【实验验证】请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴加 往往B中滴加 |
若 则假设1成立; 若 则假设2成立. |
考点:探究物质的组成或测量物质的含量,氧化性、还原性强弱的比较
专题:实验探究和数据处理题
分析:Ⅰ、依据图表实验数据分析,第二组是加入稀硫酸,反应褪色时间缩短,第三组是升温,反应速率较大幅度增大,第四组加入硫酸锰反应速率最快是起到催化作用;
Ⅱ、(1)依据溶液配制和滴定实验步骤分析需要的仪器,注意量取溶液的体积是精确量取,草酸是酸,高锰酸钾溶液具有强氧化性,需要用酸式滴定管;
(2)H2C2O4溶液与酸性KMnO4溶液反应发生氧化还原反应生成二氧化碳,锰离子和水;
(3)依据滴定实验数据和离子方程式计算得到;
Ⅲ、检验铁离子用硫氰酸钾溶液变红色检验,检验碘单质用淀粉溶液变蓝检验;将少量氯化铁溶液滴入碘化钾淀粉溶液中若变蓝色证明;
Ⅱ、(1)依据溶液配制和滴定实验步骤分析需要的仪器,注意量取溶液的体积是精确量取,草酸是酸,高锰酸钾溶液具有强氧化性,需要用酸式滴定管;
(2)H2C2O4溶液与酸性KMnO4溶液反应发生氧化还原反应生成二氧化碳,锰离子和水;
(3)依据滴定实验数据和离子方程式计算得到;
Ⅲ、检验铁离子用硫氰酸钾溶液变红色检验,检验碘单质用淀粉溶液变蓝检验;将少量氯化铁溶液滴入碘化钾淀粉溶液中若变蓝色证明;
解答:
解:Ⅰ、依据图表实验数据分析,第二组是加入稀硫酸,反应褪色时间比第一组缩短,第三组是升高温度,反应速率较大幅度增大,每升高10°C反应速率增大为原来的2.25倍,第四组加入硫酸锰,反应速率最快,为第三组的13倍多,说明是起到催化作用;
故答案为:稀硫酸可以使上述反应速率加快,升温反应速率加快且温度升高10°C反应速率增大为原来的2.25倍,Mn2+做该反应的催化剂,可加快反应速率;
Ⅱ、(1)用托盘天平称取草酸晶体(H2C2O4?2H2O)Wg;配制成250mL溶液需要的仪器玻璃棒、烧杯、胶头滴管、250mL容量瓶;每次移取25.00 mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定,需要锥形瓶,高锰酸钾溶液具有强氧化性,草酸具有酸性,选择酸式滴定管准确量取;
故答案为:酸式滴定管;
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O;
(3)25ml溶液用高锰酸钾溶液滴定,若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,依据离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O,计算250ml溶液中草酸物质的量=
×10=2.5V×10-5mol,则草酸晶体的纯度为=
×100%=
%;
故答案为:
%;
Ⅲ、假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强,检验铁离子用硫氰酸钾溶液变红色检验,检验碘单质用淀粉溶液变蓝检验,将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴如KSCN溶液振荡,向B试管中加入淀粉溶液,若A试管中溶液变红色,B不变蓝色,证明加入、假设1正确,若A试管中溶液不变红色,试管B中变蓝色,证明假设2正确;
故答案为:
证明I-的还原性强于Fe2+ 的简单实验是:将少量氯化铁溶液滴入碘化钾淀粉溶液中若变蓝色证明碘离子的还原性大于亚铁离子,2Fe3++2I-=2Fe2++I2;
故答案为:将少量氯化铁溶液滴入碘化钾淀粉溶液中若变蓝色证明碘离子的还原性大于亚铁离子;
故答案为:稀硫酸可以使上述反应速率加快,升温反应速率加快且温度升高10°C反应速率增大为原来的2.25倍,Mn2+做该反应的催化剂,可加快反应速率;
Ⅱ、(1)用托盘天平称取草酸晶体(H2C2O4?2H2O)Wg;配制成250mL溶液需要的仪器玻璃棒、烧杯、胶头滴管、250mL容量瓶;每次移取25.00 mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定,需要锥形瓶,高锰酸钾溶液具有强氧化性,草酸具有酸性,选择酸式滴定管准确量取;
故答案为:酸式滴定管;
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O;
(3)25ml溶液用高锰酸钾溶液滴定,若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,依据离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O,计算250ml溶液中草酸物质的量=
| 5×V×10-3L×0.10mol/L |
| 2 |
| 2.5V×10-5mol×126g/mol |
| Wg |
| 31.5V |
| W |
故答案为:
| 31.5V |
| W |
Ⅲ、假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强,检验铁离子用硫氰酸钾溶液变红色检验,检验碘单质用淀粉溶液变蓝检验,将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴如KSCN溶液振荡,向B试管中加入淀粉溶液,若A试管中溶液变红色,B不变蓝色,证明加入、假设1正确,若A试管中溶液不变红色,试管B中变蓝色,证明假设2正确;
故答案为:
| 实验步骤 | 预期现象和结论 |
| 将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴加 KSCN溶液.振荡: 往往B中滴加 淀粉溶液.振荡? |
若 A变红色,B不变色. 则假设1成立; 若 A不变色,B变蓝色. 则假设2成立. |
故答案为:将少量氯化铁溶液滴入碘化钾淀粉溶液中若变蓝色证明碘离子的还原性大于亚铁离子;
点评:本题考查了物质含量的实验分析,实验判断计算,溶液配制和滴定实验的分析应用,离子还原性的实验设计和实验分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列电离或离子方程式正确的是( )
| A、亚硫酸的电离:H2SO3?2H++SO32- |
| B、氯化铵水解的离子方程式为:NH4++H2O?NH3?H2O+H+ |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、向氯化铝溶液中加入过量的氨水:A13++3NH3?H2O=Al(OH)3↓+3NH4+ |
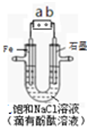 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
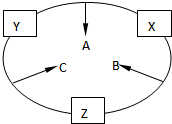 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个. 实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
实验室用如图装置完成表中的四个实验,不能得到实验目的是( )

 元素及其化合物在生产、生活中具有广泛的用途.
元素及其化合物在生产、生活中具有广泛的用途.