题目内容
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20.某硫酸铜溶液中c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,应调整溶液pH使之大于( )
| A、3 | B、5 | C、7 | D、9 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:根据氢氧化铜的溶度积:Ksp=c(Cu2+)?[c(OH-)]2计算出生成氢氧化铜沉淀时氢氧根离子的浓度,然后根据水的离子积计算出氢离子浓度,最后根据氢离子浓度得出溶液的pH.
解答:
解:氢氧化铜的溶度积:Ksp=c(Cu2+)?[c(OH-)]2=2×10-20,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则氢氧根离子的物质的量浓度至少为:c(0H-)=
mol/L=1×10-9mol/L,
所以溶液中氢离子浓度为:c(H+)=
mol/L=10-5mol/L,
所以溶液的pH=5,若要生成Cu(OH)2沉淀,应调整溶液pH>5,
故选B.
|
所以溶液中氢离子浓度为:c(H+)=
| 1×10-14 |
| 1×10-9 |
所以溶液的pH=5,若要生成Cu(OH)2沉淀,应调整溶液pH>5,
故选B.
点评:本题考查了难溶电解质的沉淀溶解平衡的简单计算,题目难度中等,注意掌握溶度积的概念、表达式,能够根据溶液中的离子浓度进行简单的溶解平衡的计算.

练习册系列答案
相关题目
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )| A、b极发生氧化反应 |
| B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C、放电时,电流从a极经过负载流向b极 |
| D、其中的离子交换膜需选用阳离子交换膜 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、22.4L水蒸气中含有NA个H2O分子 |
| B、16g 氧气和16g 臭氧含有的电子总数均为8NA |
| C、1 mol乙炔分子中含3NA个碳碳叁键 |
| D、2.3g金属钠与乙醇反应时失去的电子数是0.1NA |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这儿种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba( NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba( NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是SO32-、Br-; Na+、K+离子至少有一种存在 |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响 |
在FeBr2和FeI2混合溶液中逐渐通入氯气,可能发生反应的离子方程式是( )
| A、Fe2++Cl2→Fe3++2Cl- |
| B、2Fe2++2Br-+2I-+3C12→2Fe3++I2+Br2+6Cl- |
| C、2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl- |
| D、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
| E、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体.C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体.C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题: 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A,B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ.请回答下列问题:
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A,B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ.请回答下列问题: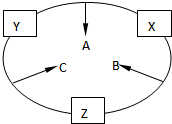 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.