题目内容
7. 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反应为:
(1)IO3-+5I-+6H+→3I2+3H2O
(2)I2+2S2O${\;}_{3}^{2-}$→2I-+S4O62-
具体步骤为:
a.称取10.000g食盐,准确配成100mL溶液;
b.取上述试样溶液10.00mL,用稀硫酸酸化,加入2%KI溶液,使KIO3与KI反应完全.
c.以A试液为指示剂,用物质的量浓度为0.0001mol•L-1的Na2S2O3溶液逐滴进行滴定.当加入Na2S2O3溶液10.00mL时,滴定到达终点.
请完成下列填空:
(1)定性判断精制食盐是否含碘,除水、稀硫酸、Na2S2O3溶液外,还需要的试剂是淀粉、KI溶液.
(2)步骤a中需要用到的仪器为:烧杯、玻棒、胶头滴管、100mL容量瓶、电子天平.
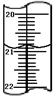
(3)步骤b中要使KIO3与KI反应完全,加入的KI溶液必须过量.用滴定管取试样溶液10.00mL时,末读数如图所示,此末读数为20.80mL.
(4)步骤c中A试液是淀粉试液,滴定终点的现象为蓝色消失,半分钟保持不变.
(5)该食盐含碘量22.86 mg/kg,该实验数据可能存在误差,为减少实验操作带来的误差,应该多次实验后取平均值.
(6)测定过程中,下列操作会导致最终所测得食盐含碘量偏高的是cd
a.精确配制100mL食盐溶液时,定容时仰视读数
b.精确配制100mL食盐溶液时,烧杯未洗涤并转移洗液
c.滴定过程中,滴定管漏液在锥形瓶外
d.滴定前,滴定管下端尖嘴处有气泡,滴定后气泡消失.
分析 (1)根据题中反应原理及滴定过程判断,还需要指示剂淀粉和碘化钾溶液;
(2)注意称量的质量是10.000g食盐,必须使用电子天平,不能使用托盘天平;
(3)KIO3与KI反应完全,碘化钾溶液必须过量;根据滴定管的构造读出体积,必须读到0.01mL;
(4)反应原理设计了碘单质的反应,可以选用淀粉做指示剂;根据滴定终点的判断方法完成;
(5)根据反应方程式找出关系式IO3-~3I2~6S2O32-,计算出IO3-物质的量,就等于碘元素的物质的量,再计算出1kg食盐中含有的碘的质量;减少实验操作带来的误差,可以采用多次操作取平均值的方法;
(6)a、仰视读数,配制的溶液体积偏大,浓度偏小;
b、烧杯未洗涤并转移洗液,导致溶液中溶质的物质的量减小,配制的溶液浓度偏小;
c、滴定管漏液在锥形瓶外,消耗的标准液体积变大;
d、滴定前有气泡,导致消耗的标准液体积变大.
解答 解:(1)题中反应原理(1)IO3-+5I-+6H+→3I2+3H2O、(2)I2+2S2O32-═2I-+S4O62-,结合滴定过程,需要用淀粉做指示剂,还缺少碘化钾溶液,
故答案是:淀粉、KI溶液;
(2)根据质量要求达到0.001g,需要使用电子天平,还需要100mL容量瓶,
故答案是:100mL容量瓶、电子天平;
(3)加入的碘化钾溶液必须过量,才能使KIO3与KI反应完全;滴定管的每个小刻度线是0.10ml,两个滴定管读数相差0.10,读数应该是:20.80mL,
故答案是:过量;20.80;
(4)反应原理中有碘单质的反应,可以选用淀粉作为指示剂;滴定终点判断方法是:蓝色消失,半分钟保持不变,
故答案是:淀粉试液;蓝色消失,半分钟保持不变;
(5)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样溶液10.00mL中:n(I)=n(IO3-)=$\frac{1}{6}$n(S2O32-)=$\frac{1}{6}$×0.0001 mol•L-1×(20.80-10.00)×10-3L=1.8×10-7mol,10.000g食盐含有的碘原子物质的量是1.8×10-6mol,1000g食盐中含有的碘原子的质量是:127×1.8×10-6×100=22.86mg,多次操作取平均值可以减小误差,
故答案是:22.86;多次实验后取平均值;
(6)a、精确配制100mL食盐溶液时,定容时仰视读数,导致配制的溶液的体积偏大,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故a错误;
b、精确配制100mL实验溶液时,烧杯未洗涤并转移洗液,配制的溶液溶质的物质的量减少,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故b错误;
c、滴定过程中,滴定管漏液在锥形瓶外,消耗的标准液变大,测定结果偏高,故c正确;
d、滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失,导致消耗的标准液体积变大,测定结果偏高,故d正确;
故选cd.
点评 本题考查了测定食盐中碘的含量方法,题量比较大,涉及了试剂选择、仪器选择、误差分析、含量计算等知识,注意合理分析题中信息,根据所学知识完成,本题难度中等.

| A. | KN03 | B. | NH4NO3 | C. | CaC2 | D. | P4(白磷) |
| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
| A. |  分离水和CCl4 | B. |  干燥Cl2 干燥Cl2 | C. |  转移溶液 | D. | 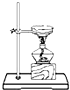 蒸发食盐水 |
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |

 ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.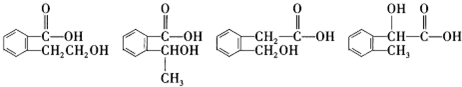 (任写两种).
(任写两种).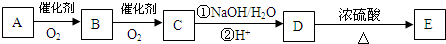
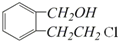 .
.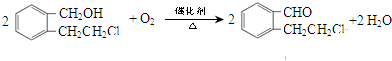 .
.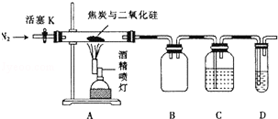 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.