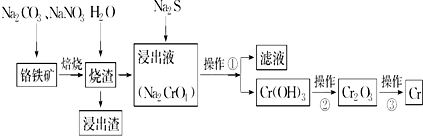
题目内容
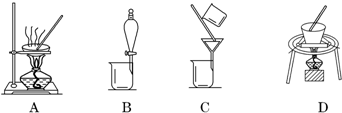
19.下列能达到实验目的是( )| A. | 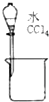 分离水和CCl4 | B. | 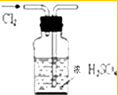 干燥Cl2 干燥Cl2 | C. | 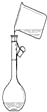 转移溶液 | D. | 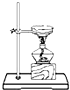 蒸发食盐水 |
分析 A.水和CCl4不溶;
B.导管长进短出;
C.转移液体需要引流;
D.蒸发需要用玻璃棒不断搅拌.
解答 解:A.水和CCl4不溶,可用分液分离,故A正确;
B.导管长进短出,否则会将液体排除,故B错误;
C.转移液体需要用玻璃棒引流,故C错误;
D.蒸发需要用玻璃棒不断搅拌,防止液体溅出,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
14.下列玻璃仪器中能用于直接加热的是( )
①蒸馏烧瓶 ②蒸发皿 ③试管 ④容量瓶 ⑤坩埚 ⑥量筒 ⑦烧杯.
①蒸馏烧瓶 ②蒸发皿 ③试管 ④容量瓶 ⑤坩埚 ⑥量筒 ⑦烧杯.
| A. | ②③⑤ | B. | ①③⑦ | C. | ④⑥ | D. | ③ |
9.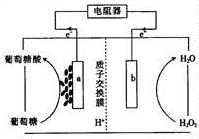 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
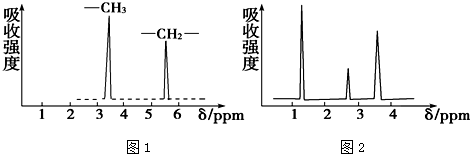
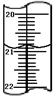 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.