题目内容
13.下列离子组能大量共存的是( )| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
分析 A.氢离子、亚铁离子都不与次氯酸根离子反应;
B.镁离子与氢氧根离子反应生成氢氧化镁程度;
C.四种离子之间不反应,能够共存;
D.硅酸根离子与钙离子反应生成硅酸钙沉淀.
解答 解:A.ClO-、与H+、Fe2+发生反应,在溶液中不能大量共存,故A错误;
B.OH-、Mg2+之间反应生成难溶物氢氧化镁,在溶液中不能大量共存,故B错误;
C.Cu2+、H+、Cl-、NO3-之间不发生反应,能够大量共存,故C正确;
D.SiO32-、Ca2+之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
3.下列过程只破坏离子键的是 ( )
| A. | KClO3分解得氧气 | B. | NaHSO4加热熔化 | C. | KHSO4晶体溶于水 | D. | NH4Cl受热分解 |
1.为了探究铁及其化合物的氧化性或还原性,某同学设计如下实验方案,其中符合实验
要求且完全正确的是( )
要求且完全正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 | 离子反应 |
| A | 向FeCl2溶液中加入Zn片 | 浅绿色溶液变为无色 | Zn具有还原性 | Fe2++Zn═Zn2++Fe |
| B | 向FeCl2溶液中滴新制氯水 | 浅绿色溶液变为棕黄色 | Fe2+具有还原性 | 2Fe2++Cl2═2Fe3++2Cl- |
| C | 向FeCl3溶液中加入铁粉 | 棕黄色溶液变为浅绿色 | Fe具有还原性 | Fe+Fe3+═2Fe2+ |
| D | 向FeCl3溶液中加入铜粉 | 蓝色溶液变为棕黄色 | Fe3+具有氧化性 | Fe3++Cu═Fe2++Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
5.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
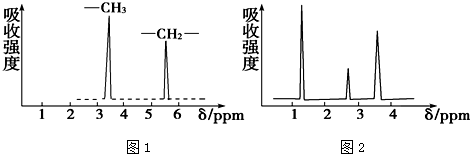
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.