题目内容
12.实验室一试剂瓶的标签严重破损,只能隐约看到下列一部分“ ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.(1)通过计算可知该有机物的分子式为:C9H10O3.
(2)进一步实验可知:
①该物质能与碳酸氢钠溶液反应生成无色无味气体.
②16.6g 该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况).
则该物质的结构可能有4种,请写出其中任意两种同分异构体的结构简式
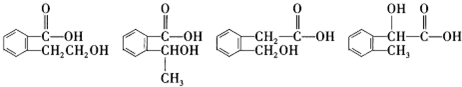 (任写两种).
(任写两种).(3)若下列转化中的D是(2)中可能结构中的一种,且可发生消去反应;E含两个六元环;取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀.
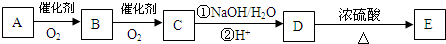
A的结构简式为
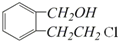 .
.(4)写出A转化成B的化学方程式:
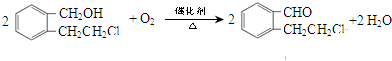 .
.(5)反应类型:C→D的①取代反应或水解反应,D→E取代反应或酯化反应.
分析 (1)39.6g CO2与9g H2O中所含C的质量为39.6÷44×12=10.8g,H的质量为9÷18×2=1g,16.6g该物质所含O的质量为16.6-10.8-1=4.8,故该物质中C、H、O的原子个数比为(108÷12):(1÷1):(4.8÷16)=9:10:3,据此判断该物质的分子式;
(2)该物质能与碳酸氢钠溶液反应生成无色无味气体,故该物质含有羧基;16.6g 该物质的物质的量为0.1mol,氢气2.24L,物质的量为0.1mol,故1mol该物质与钠反应生成1mol氢气,故该物质中除了含有1个羧基外,还含有1个醇羟基,故该物质可能的结构简式为: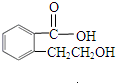 ,
, ,
, ,
, ;
;
(3)D是(2)中可能结构中的一种,且可发生消去反应;E含两个六元环,故D为 ,
, 在浓硫酸作用下发生取代反应生成E,E为
在浓硫酸作用下发生取代反应生成E,E为 ,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀,C中含有氯原子,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后得到
,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀,C中含有氯原子,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后得到 ,故C为
,故C为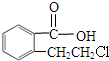 ,B催化氧化得到
,B催化氧化得到 ,B为
,B为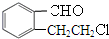 ,A催化氧化得到
,A催化氧化得到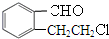 ,A为
,A为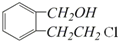 ,再结合对应有机物的结构和性质,据此解答.
,再结合对应有机物的结构和性质,据此解答.
解答 解:(1)39.6g CO2与9g H2O中所含C的质量为39.6÷44×12=10.8g,H的质量为9÷18×2=1g,16.6g该物质所含O的质量为16.6-10.8-1=4.8,
故该物质中C、H、O的原子个数比为108÷12:1÷1:4.8÷16=9:10:3,
故该物质的分子式为C9H10O3,
故答案为:C9H10O3;
(2)该物质能与碳酸氢钠溶液反应生成无色无味气体,故该物质含有羧基;16.6g 该物质的物质的量为0.1mol,氢气2.24L,物质的量为0.1mol,故1mol该物质与钠反应生成1mol氢气,故该物质中除了含有1个羧基外,还含有1个醇羟基,故该物质可能的结构简式为: ,
, ,
, ,
, ,共4种,
,共4种,
故答案为:4; ;
;
(3)D是(2)中可能结构中的一种,且可发生消去反应;E含两个六元环,故D为 ,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀,C中含有氯原子,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后得到
,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀,C中含有氯原子,C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后得到 ,故C为
,故C为 ,B催化氧化得到
,B催化氧化得到 ,B为
,B为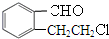 ,A催化氧化得到
,A催化氧化得到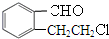 ,A为
,A为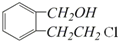 ,
,
故答案为: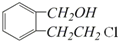 ;
;
(4)A催化氧化得到B,化学方程式为: ,
,
故答案为: ;
;
(5)C→D的①为取代反应或水解反应,D→E为取代反应或酯化反应,
故答案为:取代反应或水解反应;取代反应或酯化反应.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生分析推断能力,注意结合题给信息分析解答,难点是同分异构体种类判断.

| A. | 加入Mg能放出H2的溶液K十、Al3+、Cl一、SO42- | |
| B. | 存在较多的H十、SO42-、NO3-的溶液中Fe3+、CH3COO-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:SO32-、NH4+、NO3-、Na+ | |
| D. | 使甲基橙呈红色的溶液NH4+、K+、[Al(OH)4]-、HCO3- |
| A. | NaOH的碱性比LiOH的弱 | |
| B. | HCl、HBr、HI的热稳定性依次增强 | |
| C. | HClO4的酸性比H2SO4强说明氯元素的非金属性比硫元素强 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:M>R |
①NaOH和Al2(SO4)3
②Na2CO3和稀HCl
③Ba(OH)2和H2SO4
④HCl和NaAlO2.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | KAl(SO4)2水解可生成Al(OH)3胶体,可用于自来水的净化 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
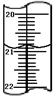 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
 ②
②

 试剂W
试剂W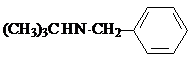 .
. .
. 生成高聚物的结构简式
生成高聚物的结构简式 .
. (无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)
(无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)