题目内容
18.普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸表面涂覆明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,其中的化学原理是明矾水解产生酸性环境,在酸性条件下,纤维素水解,使高分子链断裂;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O.
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是过量的碱同样可以导致纤维素的水解,造成书籍污损.
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防治酸性腐蚀的原理Zn(C2H5)2+H2O=ZnO+2C2H6↑,ZnO+2H+=Zn2++H2O.
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①□FeTiO3+□C+□Cl2$\frac{\underline{\;900℃\;}}{\;}$□TiCl4+□FeCl3+□CO
②□TiCl4+□O2$\frac{\underline{\;1000-1400℃\;}}{\;}$□TiO2+□Cl2.
分析 (1)酸性腐蚀主要与造纸中涂覆明矾的工艺有关,明矾水解产生氢离子;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,碳酸钙与氢离子反应;
(2)①碱性溶液中,纤维素也水解;
②Zn(C2H5)2可以与水反应生成氧化锌和乙烷,且ZnO与氢离子反应;
(3)①C元素的化合价由0升高为+2价,Cl元素的化合价由0降低为-1价;
②Cl元素的化合价升高,O元素的化合价降低,结合电子、原子守恒配平.
解答 解:(1)发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,其中的化学原理是明矾水解产生酸性环境,在酸性条件下,纤维素水解,使高分子链断裂;防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:明矾水解产生酸性环境,在酸性条件下,纤维素水解,使高分子链断裂;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是过量的碱同样可以导致纤维素的水解,造成书籍污损,
故答案为:过量的碱同样可以导致纤维素的水解,造成书籍污损;
②该方法生成氧化锌及防治酸性腐蚀的原理Zn(C2H5)2+H2O=ZnO+2C2H6↑,ZnO+2H+=Zn2++H2O,
故答案为:Zn(C2H5)2+H2O=ZnO+2C2H6↑,ZnO+2H+=Zn2++H2O;
(3)①C元素的化合价由0升高为+2价,Cl元素的化合价由0降低为-1价,由电子、原子守恒可知,反应为2FeTiO3+6C+7Cl2$\frac{\underline{\;900℃\;}}{\;}$2TiCl4+2FeCl3+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;900℃\;}}{\;}$2TiCl4+2FeCl3+6CO;
②Cl元素的化合价升高,O元素的化合价降低,结合电子、原子守恒可知反应为TiCl4+O2$\frac{\underline{\;1000-1400℃\;}}{\;}$TiO2+2Cl2,
故答案为:TiCl4+O2$\frac{\underline{\;1000-1400℃\;}}{\;}$TiO2+2Cl2.
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息、盐类水解、氧化还原反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的配平方法及应用,题目难度不大.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(2)上述反应T1℃时的平衡常数K1=4.
(3)上述反应T1℃时达到平衡后,再通入0.1mol的NO的气体,则达到新平衡时NO的转化率为80%.
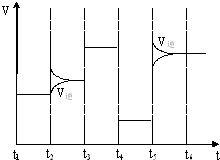
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,
且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断温度的高低T1<T2,该反应△H<0.
| A. | 1 mol氧为32 g | |
| B. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L | |
| C. | CO2的摩尔质量为44 | |
| D. | 2 mol•L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速度v (N2)=1.875×10-4mol•L-1•s-1;
(2)在该温度下,反应的平衡常数K=5000,若升高温度时,K值变小,则该反应的△H<0 (填写“>”、“<”、“=”);
(3)若在容器中发生上述反应,达平衡后,下列措施能提高NO转化率的是CD
A.加入催化剂 B.升高温度 C.降低温度D.缩小容器体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组对比实验,部分实验条件已经填在下面实验设计表中,请在下面设计表的空格中填入剩余的实验条件数据.
| 实验编号 | T/℃ | NO初始浓度 ( mol•L-1) | CO初始浓度 ( mol•L-1) | 催化剂的比表面积 ( m2•g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |

 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题: